关于下列各装置图的叙述中,错误的是( )
| A.实验室用装置①蒸馏石油 |
| B.装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸 |
| C.装置③可用于制备氢氧化亚铁并观察其颜色 |
| D.装置④是电解精炼铜,b极为粗铜,发生氧化反应 |
密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g) ΔH<0。该反应的速率(v)随时间(t)变化的关系如下图:
2Z(g) ΔH<0。该反应的速率(v)随时间(t)变化的关系如下图: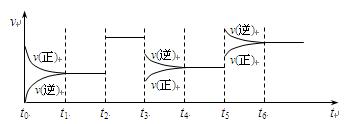
t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。
下列说法中正确的是
| A.t4~t5时间内转化率一定最低 | B.t3时降低了温度 |
| C.t5时增大了压强 | D.t2时加入了催化剂 |
将V1mL1.0mol·L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是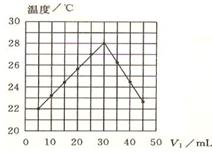
| A.做该实验时环境温度为22℃ |
| B.该实验表明化学能可转化为热能 |
| C.NaOH溶液的物质的量浓度约为1.0mol/L |
| D.该实验表明有水生成的反应都是放热反应 |
已知NaHSO4在水中的电离方程式为:NaHSO4==Na++H++SO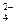 某温度下向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。
某温度下向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。
下列叙述中,不正确的是
| A.该温度高于25℃ |
| B.由水电离出来的H+的浓度是1.0×10-12mol·L-1 |
| C.加入NaHSO4晶体抑制了水的电离 |
| D.该温度下加入等体积pH为10的NaOH溶液可使该溶液恰好呈中性 |
在容积相同的甲、乙两个密闭容器中,均分别加入2molSO2和1mol O2,同时发生下列反应:2SO2(g)+O2(g) 2SO3(g),在相同温度下达到平衡。若甲容器保持体积不变,乙容器保持压强不变,测得甲容器中SO2的转化率为25%,则下列说法中正确的是
2SO3(g),在相同温度下达到平衡。若甲容器保持体积不变,乙容器保持压强不变,测得甲容器中SO2的转化率为25%,则下列说法中正确的是
| A.反应过程中的某时刻,甲容器中的反应速率比乙中的大 |
| B.达到平衡时,甲容器反应所需时间比乙容器少 |
| C.乙容器中SO2的转化率大于25% |
| D.平衡时,乙容器中SO2、O2、SO3的浓度之比一定为2:1:2 |
在298K、100kPa时,已知下列反应:
2H2O(g) = O2(g) + 2H2(g) ΔH1
Cl2(g) + H2(g) =" 2HCl(g)" ΔH2
O2(g) +4HCl(g) =2Cl2(g) + 2H2O(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是
| A.ΔH3=-ΔH1+2ΔH2 | B.ΔH3=-ΔH1+ΔH2 |
| C.ΔH3=-ΔH1_2ΔH2 | D.ΔH3=-ΔH1-ΔH2 |