20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。分析图中信息,回答下列问题:
(1)图一是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 。在反应体系中加入催化剂,E1和E2的变化是:E1_________,E2________(填“增大”、“减小”或“不变”),对反应热是否有影响?_______________,原因是_________ 。
(2)图二是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程与能量关系图(图中的△H表示生成1mol产物的数据)。根据图二回答下列问题:
① P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式 。
② P(s)和Cl2(g)分两步反应生成1molPCl5(g)的△H1与P(s)和Cl2(g)一步反应生成1molPCl5(g)的△H2关系是:△H2______△H1(填“大于”、“小于”或“等于”),原因是 。
氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5 kJ,则该反应的热化学方程式为。
(2)298 K时,在2 L固定体积的密闭容器中,发生可逆反应:
2NO2(g) N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题: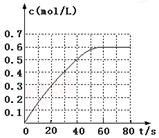
① 298k时,该反应的平衡常数为L·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是:
A.混合气体的密度保持不变;
B.混合气体的颜色不再变化;
C.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)="0.6" mol,n(N2O4)="1.2" mol,则此时V(正)V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。
现向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,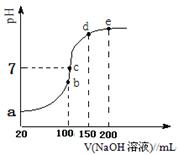
①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序。
③d、e点对应溶液中,水电离程度大小关系是de(填“>”、“<”或“=”)。
(14分)“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需 |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
| 3 |
900 |
a |
b |
c |
d |
t |
①实验2条件下平衡常数K=。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值_______(填具体值或取值范围)。
③实验4,若900 ℃时,在此容器中加入CO、H2O、CO2、H2均为1 mol,则此时V正V逆(填“<”,“>”,“=”)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ΔH=-1275.6 kJ·mol-1
②2CO (g)+ O2(g) = 2CO2(g)ΔH=-566.0 kJ·mol-1
③H2O(g) = H2O(l)ΔH=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________
(3)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10 mL 0.01 mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系;
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4 mol·L-1,则生成沉淀所需CaCl2溶液的最小浓度为______________mol·L-1。
(5)以二甲醚(CH3OCH3)、空气、H2SO4为原料,铂为电极可构成燃料电池,其工作原理与甲烷燃料电池的原理相似。请写出该电池负极上的电极反应式:。
(14分)已知:CH3COOH CH3COO-+H+达到电离平衡时,电离平衡常数可以表示为Ka=
CH3COO-+H+达到电离平衡时,电离平衡常数可以表示为Ka=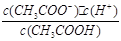 ;CH3COO-+H2O
;CH3COO-+H2O CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh=
CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh=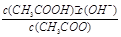 (式中各粒子浓度均为平衡时浓度)。
(式中各粒子浓度均为平衡时浓度)。
(1)对于任意弱电解质来讲,其电离平衡常数Ka、对应离子的水解常数Kh以及水的离子积常数Kw的关系是_______________,由此可以推断,弱电解质的电离程度越小,其对应离子的水解程度____________。如在25 ℃时碳酸的K1草酸的K1(填“大于”、“等于”或“小于”),所以,在相同条件下,碳酸氢钠的溶液显性,而草酸氢钠溶液显酸性。
(2)由于CH3COOH的电离程度很小,计算时可将CH3COOH的平衡浓度看成是CH3COOH溶液的浓度,则c mol·L-1的CH3COOH溶液中c(H+)=_________(不为0)。
(3)现用某未知浓度(设为c′)的CH3COOH溶液及其他仪器、药品,通过实验测定一定温度下CH3COOH的电离平衡常数,需测定的数据有(用简要的文字说明):
①实验时的温度;②______________;③用____________(填一种实验方法)测定溶液浓度c′。
(16分)化学实验有助于理解化学知识,提升科学素养。
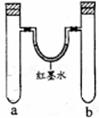
I.某探究小组用以下右图装置做如下实验。
| 实验编号 |
a中试剂 |
b中试剂 |
 |
| 1 |
0.1克Na、3 mL水 |
0.1克Na、3 mL乙醇 |
|
| 2 |
3 mL水 |
3 mL饱和FeSO4溶液 |
(1)实验1:同时加入试剂,反应开始阶段可观察到U形管中液面(填编号,下同),反应结束静置一段时间,最终U形管中液面。
a.左高右低 b.左低右高c.左右基本持平
(2)实验2:一段时间后观察到U形管中液面左低右高, b管溶液中出现红褐色浑浊物,请解释出现上述现象的原因:。
II.某研究小组为探究弱酸性条件下铁的电化学腐蚀类型,将混合均匀的新制铁粉和炭粉置于锥形瓶底部,塞上瓶塞(如图(1)所示)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(3)请填满表中空格,以完成实验设计:
| 编号 |
实验目的 |
炭粉/g |
铁粉/g |
醋酸浓度/mol/L |
| ① |
作参照实验 |
0.5 |
2.0 |
1.0 |
| ② |
探究醋酸浓度对实验的影响 |
0.5 |
0.1 |
|
| ③ |
0.2 |
2.0 |
1.0 |
(4)实验①测得容器中的压强随时间的变化如图(2)所示。该小组得出0~t1时压强增大的主要原因是:。t2时,容器中压强明显变小的原因是。请在图(3)中用箭头标出发生该腐蚀时A和B之间的电子移动方向。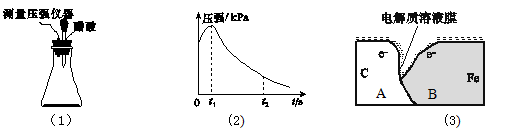
制备氢气可利用碘硫热化学循环法,其原理示意图如下。
(1)已知:①2SO3(g) 2SO2 (g) + O2 (g)△H1
2SO2 (g) + O2 (g)△H1
②H2SO4(l) SO3(g) + H2O(l)△H2
SO3(g) + H2O(l)△H2
2H2SO4(l) 2SO2 (g) + O2(g) +2H2O(l) △H3
2SO2 (g) + O2(g) +2H2O(l) △H3
则△H3=(用△H1和△H2表示)
(2)上述热化学循环制氢要消耗大量的能量,从绿色化学角度,能量供应的方案是。
(3)碘化氢热分解反应为:2HI(g) H2(g)+I2(g) △H>0。则该反应平衡常数表达式:K=;升温时平衡常数K(选填“增大”或“减小”)
H2(g)+I2(g) △H>0。则该反应平衡常数表达式:K=;升温时平衡常数K(选填“增大”或“减小”)
(4)本生(Bunsen)反应中SO2和I2及H2O发生反应为:
SO2+I2+2H2O=3H++HSO4─+2I─;I─+I2 I3─。
I3─。
①当起始时,SO2为1mol,水为16mol,溶液中各离子变化关系如下图,图中a、b分别表示的离子是、。
②在水相中进行本生反应必须使水和碘显著过量,但易引起副反应将反应器堵塞。写出浓硫酸与HI发生反应生成硫和碘的化学方程式:。