用0.2mol某元素R的单质与足量的盐酸反应,在标准状况下生成6.72L氢气。等量的R元素的单质与足量的氧气化合,可生成10.2gR元素的最高价氧化物,R元素的中子比质子多一个。则R元素为_________(填元素符号),相对原子质量为__________。
(共6分)在一定条件下,反应xA 十yB  zC达到平衡。
zC达到平衡。
(1)若A、B、C都是气体,在增压后平衡向逆反应方向移动,则x,y,z之间的关系是。
(2)若C是气体,且x+y=z,在增大压强时,如果平衡发生移动,则A的转化率将(填“增大”、“减小”或“不变”)
(3)若A为固体,B、C为气体,且y>z,则增大压强时混和气体的平均相对分子质量将(填“增大”“减小”或“不变”)
在水溶液中橙色的Cr2O72-与黄色的CrO42-有平衡关系:Cr2O72- + H2O  2CrO42-+ 2H+,把重铬酸钾溶于水配成稀溶液呈橙色。
2CrO42-+ 2H+,把重铬酸钾溶于水配成稀溶液呈橙色。
(1)向上述溶液中加入NaOH溶液,溶液呈色。
(2)向已加入NaOH溶液的溶液中再加入过量稀硫酸,则溶液应是色,因为。
(3)向原溶液中加入硝酸钡溶液(已知BaCrO4为黄色沉淀),则平衡(向左移或向右移),溶液颜色将。
2,3-二氧呋喃是抗肿瘤药物的中间体,四氢呋喃是常用溶剂,它们可以通过下列反应流程来合成: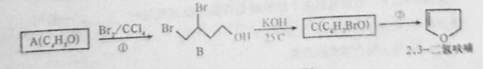
已知: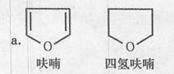
b.在碱存在的条件下,卤代烃可与酵发生如下反应:
R—X+R′—OH→R—O—R′+HX
请填写下列空白:
(1)化合物B的名称为;反应①的反应类型是;反应②的反应条件是。
(2)写出结构简式:A为;C为;A与乙酸反应生成的酯为。
(3)工业上可由二元醇D( C4H10O2)在一定条件下脱水制得四氢呋喃,该反应的化学方程式为。
(4)写出满足下列条件的呋喃的一种同分异构体的结构简式。
I.没有支链,且一元取代产物只有两种。
Ⅱ.不能与银氨溶液发生银镜反应。
Ⅲ.核磁共振氢谱图有2个峰,其面积之比为1:3。
(5)2,3—二氢呋喃在一定的条件下可以转变成四氢呋喃,如何用简单的化学方法检验2,3-二氢呋喃是否完全转化?。
已知:A、B、C、D、E、F、X为周期表中前四周期的七种元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素,B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同;X的基态原子的价电子排布式为3d84s2.
请回答下列问题:
(1)B、C、D三种元素的电负性由大到小的顺序是(填元素符号)。
(2)在A元素与上述其他元素形成的分子中,其中心原子为sp3杂化的分子式为。(写出2种即)
(3)与C同族、且位于第四周期元素所形成气态化物的电子式为,它属于(填“极性”或“非极性”)分子,其沸点低于C的氢化物的沸点,主要原因是。
(4)F的基态原子核外电子排布式是。
(5)E原子的第一电离能比同周期后面相邻元素的第一电离能(填“大”或“小”)。
(6)氢气是理想的清洁能源,X元素与镧(La)元素的合金可做储氢材料,该合金的晶胞如右图所示,晶胞中心有一个X原子,其他X原子都在晶胞面上,则该晶体的化学式为。已知该晶体的密度为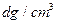 ,其摩尔质量为
,其摩尔质量为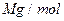 ,则该晶胞的体积是。(请列出算式)
,则该晶胞的体积是。(请列出算式)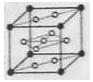
以节能减排为基础的低碳经济已成为实现人类可持续发展的重要课题。
(1)控制和治理CO2是解决温室效应的有效途径,其中一种途径是将CO2转化成有机物实现碳循环。如2CO2(g)+2H2O(1)C2H4(g)+3O2(g)△H=+1411.0kJ/mol
2CO2(g)+3H2O(1)C2H5OH(1)+3O2(g)△H=+1366.8kJ/mol
则由C2H5OH(1)转化为C2H4(g)和H2O(1)的热化学方程式为。
(2)为探究反应6H2(g)+2CO2(g)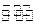 CH3CH2OH(g)+3H2O(g)发生的适宜条件,现改变氢碳比[n(H2)/n(CO2)]和温度等条件进行了如下实验:
CH3CH2OH(g)+3H2O(g)发生的适宜条件,现改变氢碳比[n(H2)/n(CO2)]和温度等条件进行了如下实验:
根据表中实验数据分析:
①该反应的正反应为(填“吸热”或“放热”)反应。
②为提高CO2的平衡转化率,可采取的措施有(写出一条即可)。
(3)一定条件下,将3 mol H2和1mol CO2气态混合物充入2L密闭容器中,发生如下反应:3H2(g)+CO2(g)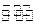 CH3OH(g)+H2O(g)。2min时该反应达到平衡,测得CH3OH的物质的量浓度为0.2mol/L。下列说法正确的是。
CH3OH(g)+H2O(g)。2min时该反应达到平衡,测得CH3OH的物质的量浓度为0.2mol/L。下列说法正确的是。
A.该反应的平衡常数表达式为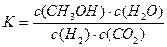 |
| B.CO2的平衡转化率为40% |
| C.2min内H2的平均反应速率为0.3mol/(L·min) |
| D.该反应达到平衡状态的标志是混合气体的密度不发生改变 |
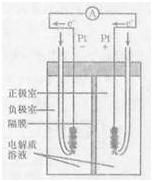
(4)右图是甲烷燃料电池的工作原理示意图,电解质溶液为KOH溶液。则负极室通入的气体是(填“甲烷”或“氧气”);正极室电极上发生的电极反应是;其电池的总反应为。比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先是能量转化效率高,其次是。