小徐和老师共同完成以下两个实验探究。
【探究一】酸和碱反应的探究
(1)请依据下图设计一个酸和碱反应的探究实验:
| 实验步骤 |
实验现象 |
结论 |
| ①向烧杯中加入10mL氢氧化钠溶液,并滴入几滴酚酞溶液; ②再用滴管慢慢滴入稀硫酸,并不断搅拌溶液。 |
① 溶液颜色__________; ② 不断搅拌溶液至溶液颜色恰好变成_____色为止。 |
酸和碱发生了中和反应,该反应属四种基本反应类型中的______反应。 |
(2)小徐选取BaCl2、酚酞、紫色石蕊溶液设计实验,分别探究上述酸、碱反应后烧杯中的硫酸是否过量,请你根据下表判断正确的实验方案及分析方案错误的原因:
| 实验方案 |
实验步骤 |
实验现象 |
实验结论 |
| 方案一 |
取样,滴入适量的氯化钡溶液 |
出现白色沉淀 |
硫酸过量 |
| 方案二 |
取样,滴入几滴无色酚酞溶液 |
酚酞溶液不变色 |
酸、碱恰好反应 |
| 方案三 |
取样,滴入几滴紫色石蕊溶液 |
溶液变红 |
硫酸过量 |
①设计的三个方案中,有一个正确的方案是:方案 。
②请分析另外两个方案错误的原因: ; 。
【探究二】对实验室制取二氧化碳后的废液进行探究
(3)小徐取大理石和稀盐酸反应后的废液50g,逐滴加入碳酸钠溶液。根据实验测得的数据绘出右图,其中纵坐标m是实验得到的沉淀或气体的质量,横坐标表示加入的碳酸钠溶液的质量。请你参与回答下列问题:
①图中oa段表示生成的 质量。
②通过计算求出图中b点溶液的溶质质量分数。(写出计算过程,最终结果保留至小数点后一位)
市售某品牌饮料的罐体是A1—Fe合金,为测定其中Al的质量分数,某学习小组精确称取0.050 g合金样品,设计了如下装置并进行实验: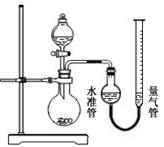
【查阅资料】:1、Al和NaOH溶液反应,放热并生成H2,反应中对应关系为2Al ~ 3H2,Fe和NaOH溶液不反应;2、实验条件下,H2的密度近似为0.090 g·L—1。
【实验步骤】:
①;②装入药品和水,连接装置;③记录量气管中水面读数为5 mL;④打开分液漏斗活塞,逐滴滴入NaOH溶液,至不再产生气泡为止,关闭活塞;⑤待温度降至室温时,记录量气管中水面读数为49 mL;⑥处理剩余药品,整理实验台。
【实验分析及数据处理】:
(1)完善实验步骤中的所缺部分;
(2)检查气密性的方法:打开分液漏斗活塞,向量气管中加入水,使水准管和量气管中水面相平,关闭活塞,降低量气管,若两侧水面高度差(填“改变”或“不变”),则气密性良好;
(3)实验结束后,读取量气管中水面刻度之前,需进行的操作是;
(4)计算此A1—Fe合金样品中Al的质量分数(3分,精确到小数点后3位);;
【实验反思】:
(5)造成实验结果偏大的原因可能是。
A.实验过程加入NaOH溶液的体积
B.没有冷却至室温就开始读数
C.装置漏气
利用铝土矿(只考虑含Al2O3及Fe2O3)生产Al的工艺流程如下,请回答下列问题:
【查阅资料】:1、铝土矿中Al2O3可以和NaOH溶液反应,反应的化学方程式为:
Al2O3 + 2NaOH ="=" 2NaAlO2 + 2H2O;2、Fe2O3不和NaOH溶液反应。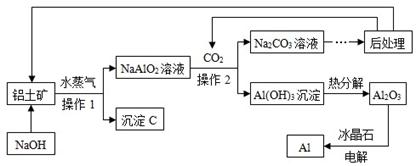
(1)工业生产中,要将铝土矿细磨预处理,目的是;
(2)沉淀C的化学式是;
(3)操作1、操作2的名称是,实验室完成此操作时,需要的玻璃仪器的是玻璃棒、烧杯和;
(4)此工艺中,可循环使用的物质是CO2、H2O和;(填化学式)
(5)电解Al2O3的化学方程式为;
(6)NaAlO2溶液中通入CO2反应的化学方程式是。
做完“铁在氧气中燃烧”实验后,小冬同学有两个疑惑不解的问题,于是她进行了以下探究活动,请你一同参与。
[问题1]铁燃烧时溅落下来的黑色物质中还有没有铁呢?
[查阅资料1]
(1)自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO极易被氧化为Fe2O3);
(2)铁的氧化物均能溶于酸溶液。
[实验探究]
将冷却后的黑色物质碾碎,装入试管,加入溶液,观察到的现象是,说明铁燃烧时溅落下来的黑色物质中还含有铁。
[问题2]铁燃烧的产物为什么不是Fe2O3呢?
[查阅资料2]
(1)Fe3O4和Fe2O3的分解温度、铁的熔点见右表: 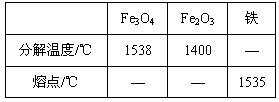
(2)Fe2O3高温时分解成Fe3O4。
[理论探讨]
根据实验现象,并结合表中数据,可推知铁在氧气里燃烧时产生的高温应在之间,在此温度范围内Fe2O3已分解,所以铁在氧气里燃烧的产物是Fe3O4。
[拓展延伸]
(1)实验中为了防止集气瓶炸裂,必须;
(2)Fe2O3高温时会分解成Fe3O4和一种气体,请写出此反应的化学方程式;
(3)有些超市的食品密封包装盒的透明盖内放有黑色的FeO粉末,若粉末的颜色变为,就说明包装盒破损进气,这样售货员就能及时发现并处理。
)化学兴趣小组同学们在课外活动中设计了如右图装置来验证某气体的化学性质。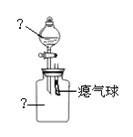
(1)请你协助完成下表中的内容。
| 仪器名称 |
分液漏斗 |
广口瓶中 |
| 装置内的药品 |
||
| 可观察到的现象 |
||
| 用化学方程式表示相关性质 |
(2)同学们又设计以下实验(如右图)研究某混合气体的组成。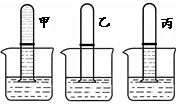
①第一组:取三支试管,在其容积的二分之一处做标记。分别充满气体(甲为CO2,乙为A气体,丙为CO2和A的混合气)后倒扣在NaOH溶液中。最终观察到的实验现象如右图所示。据此推测:气体A的化学性质有 。
②第二组:同学们利用右图所示的装置进行实验。实验步骤:关闭止水夹,向充满丙的集气瓶中注入10 ml NaOH溶液(足量),充分反应后,冷却至室温,打开止水夹。此时观察到的实验现象是 。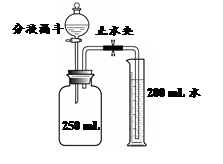
氢氧化钠与酸、二氧化碳反应没有明显现象。小军和小晴两位同学想用实验证明氢氧化钠能与盐酸、二氧化碳反应,他们做了以下探究过程。
【查阅资料】通常状况下,1体积水能溶解1体积二氧化碳。
【设计实验】小军设计了两个实验进行验证,请你帮他完成下列实验报告。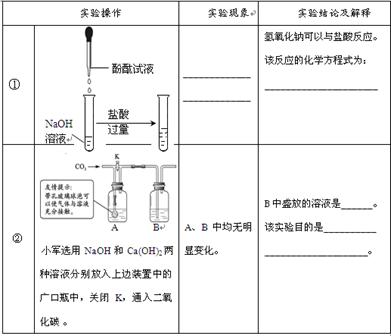
【反思交流】小晴认为:小军设计的上述两个实验都有缺陷,不足以证明氢氧化钠能与盐酸和二氧化碳反应。请你分析:
(1)小军的第一个实验的缺陷是________________,应改为_____________。
(2)小晴用上述小军第二个实验的装置和药品,验证氢氧化钠可以与二氧化碳反应,她的设计方案是:分别量取40 mLNaOH和Ca(OH)2溶液放入A、B中,_________________,
此实验可以说明氢氧化钠和二氧化碳发生了反应。
【实验结论】通过小晴的实验,证明了氢氧化钠可以与盐酸和二氧化碳反应。