新合成的一种烃,其碳架呈三棱柱体(如图所示)
(1)写出该烃的分子式 。
(2)该烃的一氯取代物是否有同分异构体 。
(3)该烃的二氯取代物有多少种 。
(4)该烃的同分异构体有多种,其中1种不能使酸性高锰酸钾溶液或溴水溶液褪色,但在一定条件下能跟溴发生取代反应、与H2发生加成反应,这种同分异构体的结构简式是 。
铁是当代社会中用量最大的金属之一。磁铁矿是工业上冶炼铁的原料之一,发生的主要反应为:Fe3O4(s)+4CO 3Fe(s)+4CO2
3Fe(s)+4CO2
(1)已知:①Fe3O4(s)+4C(石墨) 3Fe(s)+4CO(g) ΔH=+646.0 kJ/mol
3Fe(s)+4CO(g) ΔH=+646.0 kJ/mol
②C(石墨)+CO2(g) 2CO(g) ΔH=+172.5 kJ/mol
2CO(g) ΔH=+172.5 kJ/mol
由Fe3O4(s)与CO反应生成Fe(s)的热化学方程式是。
(2)T℃时,在 2L恒容密闭容器中,加入Fe3O4、CO各1.0 mol ,10 min反应达到平衡时,容器中CO2的浓度是0.4 mol /L。
①能证明该反应达到化学平衡的是(选填字母)。
a.容器内压强不再变化
b.容器内CO、CO2物质的量比为1 : 1
c.容器内气体的质量不再变化
d.生成CO2的速率与消耗CO的速率相等
②CO的平衡转化率是。
③l0 min内,反应的平均反应速率v (CO2)=。
④欲提高该反应中CO的平衡转化率,可采取的措施是(选填字母)。
a.提高反应温度 b.移出部分CO2
c.加入合适的催化剂 d.减小容器的容积
⑤T℃时,该反应的平衡常数K=。
6种相邻短周期主族元素的相对位置如下表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍。用化学用语回答下列问题:
| X |
Y |
Z |
|
| W |
M |
Q |
(1)Y在周期表中的位置是________。
(2)X、Y、Z三种元素的原子半径由大到小的顺序是________。
(3)W、M、Q三种元素最高价氧化物对应的水化物中,酸性由强到弱的顺序是________。
(4)W的最高价氧化物可以和Z的氢化物反应,利用该反应可刻蚀玻璃,反应的化学方程式是________。
(5)X的含10个电子的气态氢化物甲是一种重要的化工原料。甲的电子式是,实验室制备甲的化学方程式是________,甲可以与X的最高价氧化物对应的水化物溶液反应生成盐乙,乙溶液中的离子浓度由大到小的顺序是。X的含18个电子的气态氢化物丙可与空气构成一种环保型碱性燃料电池,电池工作时丙发生的电极反应方程式是。
(6)工业上用下图所示装置电解Q元素的钠盐溶液丁,获得一种含Q元素的消毒剂。该反应的离子方程式是。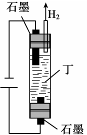
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,其中物质E是气体丙的水溶液,物质H是红褐色沉淀。它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出A、C、丙的化学式:
A、 C、丙
(2)写出反应③的化学方程式:,
反应⑤的离子方程式:。
已知某待测液由Ag+、Mg2+、K+、Ba2+、NH4+、NO3-中的若干种离子组成,进行如下实验:第一步:加入过量的稀盐酸,有白色沉淀生成。
第二步:过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
第三步:再过滤,取少量滤液,滴入NaOH溶液至溶液呈碱性,在此过程中溶液无明显现象,加热该溶液,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:
(1)分别写出第二步和第三步中所涉及的反应的离子方程式:
第二步:第三步:;
(2)待测液中一定含有、NO3-离子,一定不含有离子,还有一种离子不能确定其是否存在,要检验这种离子的实验方法是(填写实验名称和观察到的现象及结论,不要求写实验操作过程),。
(1)在一个白色点滴板的二个孔穴中分别加入火柴梗、少量CuSO4·5H2O。分别滴入几滴浓硫酸,观察现象。回答下列问题:
浓硫酸滴到火柴梗上,火柴梗变 ________(填实验现象),说明浓硫酸具有________性。
浓硫酸滴入CuSO4·5H2O中,胆矾(填实验现象),说明浓硫酸具有_________性。
(2)为探究Fe3+能转化为Fe2+,实验室提供下列试剂:铁粉、0.1mol·L-1 FeCl3溶液、0.1mol·L-1 FeCl2溶液、KSCN溶液、新制氯水。请你就实验操作、实验现象、结论完成以下填空:
取少量溶液于试管中,加入足量,充分振荡后静置,滴加1至2滴,无明显变化,说明Fe3+已转化为Fe2+。