常温下,下列溶液中的微粒浓度关系正确的是
新制氯水中加入固体.=++
=8.3的溶液:>>>
=11的氨水与=3的盐酸等体积混合:=>=
0.2溶液与0.1溶液等体积混合:
下列气体中,主要成分是甲烷的是()
| A.高热值气 | B.中热值气 |
| C.低热值气 | D.水煤气 |
下列说法中错误的是()
| A.石油中含有C5—C11的烷烃,可以通过石油的分馏得到汽油 |
| B.含C18以上烷烃的重油经过催化裂化可以得到汽油 |
| C.煤是由有机物和无机物组成的复杂混合物 |
| D.煤中含有苯和甲苯,可以通过分馏的方法将它们分离出来 |
从石油分馏得到的固体石蜡,用氯气漂白后,燃烧时会产生含氯元素的气体,这是由于石蜡在漂白时与氯气发生过()
| A.加成反应 | B.取代反应 |
| C.聚合反应 | D.催化裂化反应 |
饱和一元醛和酮的混合物共0.5 mol,质量为33.2 g,若此混合物发生银镜反应,可析出银镜43.2 g,符合题意的混合物的是()
| A.乙醛和丙酮 | B.甲醛和丙酮 |
| C.乙醛和丁酮 | D.丙醛和丁酮 |
某有机物结构简式为: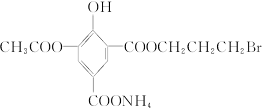 ,1 mol该物质在一定条件下与足量NaOH溶液充分反应,消耗NaOH的物质的量为()
,1 mol该物质在一定条件下与足量NaOH溶液充分反应,消耗NaOH的物质的量为()
| A.7 mol | B.6 mol | C.5 mol | D.4 mol |