为了探究HClO的漂白性,某同学设计了如下的实验。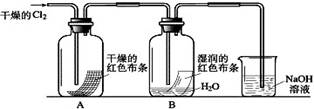
(1)通入Cl2后,从集气瓶A中干燥的红色布条的现象可得出的结论是 ;从集气瓶B中湿润的红色布条的现象可得出的结论是 ,其中发生的反应的化学方程式为 。
(2)为了确证是HClO使湿润的红色布条褪色,你认为还应增加的实验是 。
(3)烧杯中溶液所起的作用是 ,烧杯中所发生反应的化学方程式为 。
(4)为保证实验安全,当氯气以每分钟1.12L(标准状况)的流速匀速通入时,若实验需耗时4分钟,小烧杯中盛2 mol·L—1的NaOH溶液的体积至少应为__________mL。
(11分)铅蓄电池是典型的可充型电池,它的正负极隔板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2
 2PbSO4+2H2O
2PbSO4+2H2O
请完成下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是__________________;电解液中H2SO4的浓度将变__________________;当外电路通过1 mol电子时,理论上负极板的质量增加_________________g。
(2)在完全放电耗尽PbO2和Pb时,若按下图连接,电解一段时间后,则在A电极上生成_________________、B电极上生成_________________,此时铅蓄电池的正负极的极性将_________________。
下图是测定植物的某一生命活动过程的实验装置。A瓶中NaOH溶液的作用是__________________________________________________________________________,B瓶中的石灰水的作用是___________________________________________,D瓶中出现的现象是___________________________________________。此实验说明植物具有_________性质。
某化学课外小组的同学用Mg等与稀硫酸反应制H2,根据反应进行的情况,同学们得出了反应时间与产生H2的体积关系,并做出了如下图象。请回答:
(1)分析判断,_____________段化学反应速度最快,原因可能是___________________;
FG段化学反应速率较慢的原因可能是____________________________________________。
(2)为了降低该反应的反应速率,你认为可以采取哪些措施_________________(至少说出两种)。
电子工业使用的印刷线路板,是在敷有铜膜的塑料板上以涂料保护所需的线路,然后用FeCl3的溶液与未受保护的铜膜反应以去掉铜,腐蚀后的废液中含有大量的Cu2+。为了回收这一部分Cu2+并制成硫酸铜晶体(CuSO4·5H2O),常用如下步骤:
①向废液中加过量的铁屑,搅拌,静置;②滤出固体物质;③将滤出的固体物质加热煅烧;④把煅烧后的物质放在硫酸中溶解;⑤调节溶液的pH在3.4—4之间,使Fe(OH)3沉淀完全,过滤;⑥浓缩滤液,析出晶体;⑦将过滤得到的晶体溶解,再结晶。
(1)上述③步操作所得煅烧产物成分是_______________。
A.CuO B.CuO和FeO C.CuO和Fe2O3D.CuO和Fe3O4
(2)上述第⑤步操作中,调节溶液的pH宜加入的物质是_______________。
A.氧化铜粉末 B.NaOH溶液 C.稀氨水 D.Na2CO3
(3)上述第⑥步操作中,用浓缩滤液而不用蒸干溶液的主要原因是_______________。
A.蒸干所得到的物质可能含有无水硫酸铜
B.温度升高CuSO4溶解度增大
C.温度升高Cu2+被还原为Cu
D.温度升高CuSO4分解
现给你一试管二氧化氮,其他药品和仪器自选。试设计实验,要求尽可能多地使二氧化氮被水吸收。
| 实验步骤 |
现象 |
解释(可用化学方程式表示) |
|
| (1) |
|||
| (2) |
|||
| (3) |