试根据上表填空:
| A |
|
|
||||||||||||||||
| |
B |
|
|
C |
D |
E |
F |
|
||||||||||
| G |
H |
I |
J |
|
L |
K |
M |
|||||||||||
| |
|
|
|
|
|
|
N |
|
|
Q |
|
|
|
|
|
|
|
|
(1)请写出元素Q的基态原子电子排布式 ;元素N在周期表中的位置 周期 族。
(2)基态D原子核外有 个未成对电子;D2分子中分别有 个, 个π键。
(3)化合物DA5中既含离子键,又含共价键和配位键,请写出它的电子式 。
(4)表四中的元素能形成XY2型的共价分子有CE2、CL2、BK2、LE2四种,其分子的空间构型中有一种与其他三种不同,它是 (填化学式);而形成XY3型的共价分子也有四种,它们分别是DA3、DF3、DK3、LE3,其分子的空间构型中也有一种与其他三种不同,它是 (填化学式),它是由_ 键(填“极性”或“非极性”,下同)构成的 分子。
(5)第三周期8种元素按单质熔点高低的顺序如右图所示,其中序号“8”所代表的元素是 (填元素符号);其中气态氢化物稳定性最强的元素是 (填下图中的序号)。
(6)科学家证实,IK3属于共价化合物,分子式为I2K6,其结构式为下列四种中的一种,你认为正确的结构式是____________。
(7)向Q的硫酸盐溶液中加入足量的DA3的水溶液过程中,请写出发生反应的离子方程式 ;最后生成配离子的结构式为 。
.(14分)已知:①A 是一种分子量为28的气态烃;②2CH3CHO+O2 2CH3COOH。现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示(每步都使用了催化剂)。
2CH3COOH。现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示(每步都使用了催化剂)。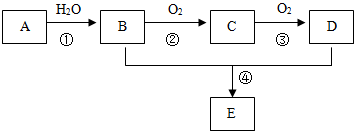
回答下列问题
(1)写出A的结构简式。
(2)B、D分子中的官能团名称分别是、。
(3)写出下列反应的反应类型:①;④。
(4)写出下列反应的化学方程式:②;
④。
(12分)下表列出了A~R 9种元素在周期表中的位置:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 二 |
E |
F |
||||||
| 三 |
A |
C |
D |
G |
R |
|||
| 四 |
B |
H |
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为。
(2)地壳中含量最多的非金属元素是(用元素符号填空)。
(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是 ,碱性最强的是,呈两性的氢氧化物是(用化学式填空)。
(4)写出D与氢氧化钠溶液反应的化学方程式: 。
主族元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3 倍。X、Y和Z分属不同的周期,他们的原子序数之和是W原子序数的5倍。在由元素W、X、Y、Z组成的所有可能的二组分化合物中,由元素W与Y形成的化合物M的熔点最高。请回答下列问题:
⑴W元素原子的L层电子排布式为,W3分子的空间构型为;
⑵化合物M的化学式为,其晶体结构与NaCl相同,而熔点高于NaCl。M熔
点较高的原因是;
⑶将一定量的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂醇酯交换合成碳酸二月桂酯。在碳酸二甲酯分子中O—C—O的键角约为;
⑷X、Y、Z可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角,Z处于体心位置,则该晶体的组成为X︰Y︰Z=。
Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2 =" 4LiCl" +S +SO2。 请回答下列问题:
请回答下列问题: (1)电池的负极材料为,发生的电极反应为;
(1)电池的负极材料为,发生的电极反应为; (2)电池正极发生的电极反应为;
(2)电池正极发生的电极反应为; (3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,实验现象是,反应的化学方程式为;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,实验现象是,反应的化学方程式为; (4)组装该电池必须在无水、无氧的条件下进行,原因是。
(4)组装该电池必须在无水、无氧的条件下进行,原因是。
高炉炼铁过程中发生的主要反应为:1/3Fe2O3(s)+CO(g) 2/3Fe(s)+CO2(g)
2/3Fe(s)+CO2(g)
| 温度/℃ |
1000 |
1150 |
1300 |
| 平衡常数 |
4.0 |
3.7 |
3.5 |
已知该反应在不同温度下的平衡常数如下:
请回答下列问题:
(1)该反应的平衡常数表达式K=,△H0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率υ(CO2)=、CO的平衡转化率= :
(3)欲提高(2)中CO的平衡转化率,可采取的措施是。
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2
D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂