A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应。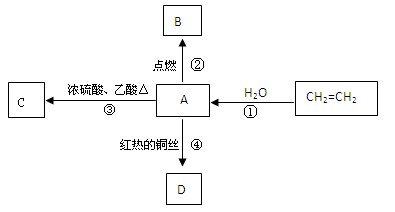
(1)写出A和C的名称或结构简式:
A ,C ;
(2)写出CH2=CH2→A的化学方程式,指出反应类型:
, 。
a、b、c是原子序数依次增大的三种常见短周期元素.由a、b、c三元素组成的化合物甲的用途如右图所示。a、b、c三元素之间两两化合可生成化合物乙、丙、丁、戊4种。化合物甲、乙、丙、丁、戊之间也能相互反应。已知乙、戊分别是由a、b两元素按原子个数1:1和2:1组成的化合物。
若a、b、c三元素形成的单质(仍用a、b、c表示)和由它们组成的化合物之间的反应关系如下(未配平)①b+c→丁②a+c→丙③乙+丁→甲④丙+丁→c+戊
试解答下列问题:
(1)写出下列物质的化学式:甲:丙:丁:
(2)写出反应③的化学方程式::
(3)戊的结构式是;实验测得化合物乙和化合物戊能以任意比相溶,根据“相似相溶”的经验规律可推测化合物乙是分子(填“极性”或“非极性”)。
(4)阅读甲的用途图,回答下列问题:
①实验室用甲作干燥剂,这是利用甲的性;甲在制TNT炸药的反应中的主要作用是。
一种白色晶体A极易溶于水,将A配成溶液进行如下框图所示的实验,实验现象及转化关系如下列框图所示。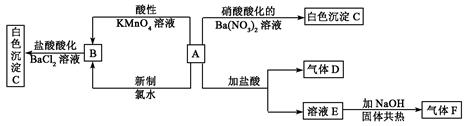
其中A为正盐,气体D能使品红溶液褪色,气体F能使湿润的红色石蕊试纸变蓝。试回答下列问题:
(1) 写出下列物质化学式:A:_________________;C:_________________;
写出下列物质化学式:A:_________________;C:_________________;
(2)写出E的电子式_____________;F的结构式__________________
(3)写出下列反应的 离子方程式:
离子方程式:
①由B生成C:________________________________________________________
②A和新制氯水反应:___________________________________________________。
(10分,每空1分)某同学在探究废干电池内的黑色固体回收利用时,进行如图示实验:
查阅教材可知,普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质。请回答以下问题:
(1)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、三角架、;
(2)操作④的试管加入③中所得黑色滤渣,试管中迅速产生能使带火星的木条复燃的气
体,据此可初步认定黑色固体为。
(3)操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测
滤渣中还存在的物质为。
(4)该同学要对滤液的成分进行检验,以确认是否含有NH4Cl和ZnCl2,下面是他做完实验后所写的实验报告,请你写出 其空白处的内容:
其空白处的内容:
| 实验目的 |
操作 |
实验现象 |
结论 |
| 1、检验Cl— |
取少许滤液于试管中, |
含有Cl— |
|
| 2、检验NH4+ |
取少许滤液于试管中, |
含有NH4+ |
|
| 3、检验Zn2+ |
取少许滤液于试管中,加入 稀氨水 |
先产生白色沉淀,继续加入氨水,沉淀又溶解 |
含有Zn2+ |
(5)根据以上的实验报告,关于滤液的成分,你的结论是:。通过一定的操作从滤液中得到固体溶质, 若要将所得固体溶质中的物质加以分离,可用法。
氰(CN)2的化学性质与卤素很相似(X2),称为拟卤素,氰能和氢气反应生成HCN,其水溶液是一种酸。氰的氧化性比溴弱、比碘强。
(1)HCN分子中含有4个共价键,写出HCN的结构式:____________。
(2)KCN溶液显碱性,原因是____________(用离子方程式表示)。
(3)下列有关方程式不正确的是____________。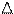 A.(CN)2+2NaOH===NaCN+NaCNO+H2O
A.(CN)2+2NaOH===NaCN+NaCNO+H2O
B.MnO2+4HCN===Mn(CN)2+(CN)2+2H2O
C.I2+2KCN===2KI+(CN)2
D.向NaBr(aq)和KCN(aq)中加入少量Cl2:Cl2+2NaBr===2NaCl+Br2
(4)处理CN-的工业废水常用ClO-氧化处理生成CNO-,反应的离子方程式如下:
aCN-+bClO-+2cOH-===dCNO-+eN2+fCO+bCl-+cH2O
上述化学方程式可能的配平化学计量数有多组,回答下列问题。
①方程式中e∶f的值为____________;
A.1B.1/2 C.2D.不能确定
②若d=e=1,则b=____________。
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略);
I 从废液中提纯并结晶出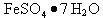 。
。
II将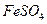 溶液与稍过量的
溶液与稍过量的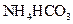 溶液混合,得到含
溶液混合,得到含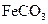 的浊液
的浊液
IV 将浊液过滤,用90。C热水洗涤沉淀,干燥后得到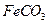 固体
固体
V煅烧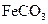 ,得到Fe2O3固体
,得到Fe2O3固体
已知: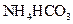 在热水中分解
在热水中分解
(1)I中,加足量的铁屑除去废液中的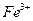 ,该反应的离子方程式是
,该反应的离子方程式是
(2)II中,生成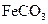 的离子方程式是。若
的离子方程式是。若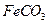 浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是。
浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是。
(3)IV中,通过检验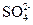 来判断沉淀是否洗涤干净。此操作是
来判断沉淀是否洗涤干净。此操作是
(4)已知煅烧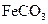 的化学方程式是
的化学方程式是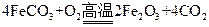 ,现煅烧464.0kg的
,现煅烧464.0kg的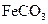 ,得到316.8kg产品,若产品中杂质只有
,得到316.8kg产品,若产品中杂质只有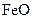 ,则该产品中Fe2O3的质量是kg(摩尔质量/g·
,则该产品中Fe2O3的质量是kg(摩尔质量/g·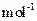 :
: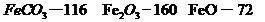 )
)