(7分)某同学用铅蓄电池作电源,用石墨作电极电解500mL某浓度的AgNO3溶液,观察到A电极表面有金属生成,B电极上有无色气体产生。当溶液中原有溶质完全电解后,停止通电,取出A极,洗涤、干燥、称量,电极增重5.4g。已知铅蓄电池的工作原理为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
请按要求回答下列问题:
(1)A电极为电解池的_____极,B电极上产生的气体为_________。
(2)电解前AgNO3溶液的物质的量浓度为____________。
(3)当反应过程中转移的电子为0.01mol时,铅蓄电池内消耗硫酸的物质的量为
mol。
(4)铅蓄电池放电时,负极质量______,正极质量_________,电解液的pH_____(填“增大”、“减小”或“不变”)。
按要求回答下列问题:
(1)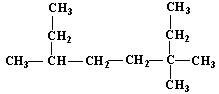 的名称为___________________________;
的名称为___________________________;
(2)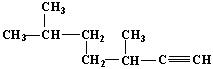 的名称为____________________________;
的名称为____________________________;
(3)2,4-二氯甲苯的结构简式为_________________________ ___;
___;
(4)某物质结构如图所示,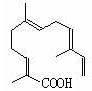
碳原子数为;
该物质可以与下列(填序号)发生反应。
| A.KMnO4酸性溶液 | B.氢气 | C.溴水 | D.NaOH溶液 |
生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Al原子的价电子排布图。
(2)根据等电子原理,写出CO分子结构式。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是;甲醛分子中碳原子轨道的杂化类型为。
②甲醛分子的空间构型是;1mol甲醛分子中σ键的数目为。
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为。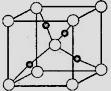
四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4︰1,其d轨道中的电子数与最外层电子数之比为5︰1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是、;杂化轨道分别是、;a分子的立体结构是。
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是晶体、晶体。
(3)X的氧化物与Y的氧化物中,分子极性较小的是(填分子式)。
(4)Y与Z比较,电负性较大的,其中W+2价离子的核外电子排布式是。
主族元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3倍。X、Y和Z分属不同的周期,它们的原子序数之和是W原子序数的5倍。在由元素W、X、Y、Z组成的所有可能的二组分化合物中,由元素W与Y形成的化合物M的熔点最高。请回答下列问题:
(1)W元素原子的L层电子排布式为,W3分子空间构型为;
(2)X单质与水发生主要反应的化学方程式为;
(3)化合物M的化学式为,其晶体结构与NaCl相同,而熔点高于NaCl。M熔点较高的原因是。将一定量的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂醇酯交换合成碳酸二月桂酯。在碳酸二甲酯分子中,碳原子采用的杂化方式有,O—C—O的键角约为;
(4)X、Y、Z可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角,Z处于体心位置,则该晶体的组成为X:Y:Z=;
(5)含有元素Z的盐的焰色反应为色。许多金属盐都可以发生焰色反应,其原因是。
研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学方程式为;利用反应6NO2+ 8NH3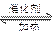 7N5+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是L。
7N5+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是L。
(2)已知:2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g)
2NO2(g)
ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=kJ·mol-1。一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。
SO3(g)+NO(g)的ΔH=kJ·mol-1。一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是。