1840年,瑞士化学家盖斯(G.H.Hess)从大量的实验事实中总结出了一条规律:化学反应不管是一步完成还是分几步完成,其反应焓变是相同的,即盖斯定律.盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应焓变虽然无法直接测得,但可以利用盖斯定律间接计算求得.已知3.6 g碳在6.4 g氧气中燃烧,至反应物耗尽.共放出x kJ热量.已知单质碳的燃烧热为了y kJ·mol-1,则1 mol C与O2反应生成CO的反应焓变△H为 ( )
| A.-y kJ·mol-1 |
| B.-(10x-y)kJ·mol-1 |
| C.-(5x-0.5y)kJ·mol-1 |
| D.(10x-y)kJ·mol-1 |
【改编】在一定条件下,下列物质不能发生消去反应的是
| A.C2H5OH | B.(CH3)2CHCl | C.(CH3CH2)3COH | D.(CH3)3CCH2Cl |
某烃的分子式为C8H10,它滴入溴水中不能使溴水褪色,但它滴入酸性高锰酸钾溶液却能使其褪色。该有机物苯环上的一氯代物有3种,则该烃是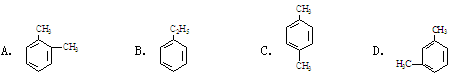
以2—氯丙烷为主要原料制1,2—丙二醇CH3CH(OH)CH2OH时,经过的反应为
| A.加成—消去—取代 | B.消去—加成—取代 |
| C.取代—消去—加成 | D.取代—加成—消去 |
下列化合物中,既能发生消去反应生成烯烃,又能发生水解反应的是
【原创】溴乙烷在氢氧化钠水溶液加热条件下的反应属于
| A.加成反应 | B.酯化反应 | C.取代反应 | D.氧化反应 |