(正常进度)
(1)写出以30%KOH溶液为电解质溶液,甲烷燃料电池的负极电极反应式______。
(2)在标准状况下,甲烷和氧气的混合气体224mL,充分燃烧后,将生成的气体通入100mL 0.02mol/L的石灰水,得到0.1g白色沉淀。求混合气体中甲烷和氧气的体积比。
在反应Fe3O4 +4CO 3Fe+4CO2中,
3Fe+4CO2中,
是氧化剂,元素被氧化,氧化产物和还原产物的物质的量之比为,若生成的CO2在标准状况下为8.96L,则该反应中转移电子为mol。
[物质结构与性质]现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1="738kJ/mol" I2 =" 1451" kJ/mol I3 =" 7733kJ/mol" I4 = 10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(1)已知BA5为离子化合物,写出其电子式
(2)B基态原子中能量最高的电子,其电子云在空间有个方向,原子轨道呈形
(3)某同学根据上述信息,推断C基态原子的核外电子排布为,
该同学所画的电子排布图违背了
(4) G位于族区,价电子排布式为
(5) DE3 中心原子的杂化方式为,用价层电子对互斥理论推测其空间构型为
(6)检验F元素的方法是,请用 原子结构的知识解释产生此现象的原因是
原子结构的知识解释产生此现象的原因是
(7) F元素的晶胞如右图所示,若设该晶胞的密度为a g/cm3,阿伏加德罗常数为NA,F原子的摩尔质量为M,则F原子的半径为cm
反应①②是重要的化工反应,D、E、F、G、M为单质,D、E、G、H为气体,且只有E为有色气体,G是空气中主要成分之一,F、M是生活中常见的金属,K是白色沉淀,C的焰色反应为黄色,P是M和紫黑色固体单质化合的产物,P、J、L、M含有同种元素,其物质间转化关系如下,虚框内是需设计的内容,反应物只能用A~N中的物质。请回答下列问题:
(1)用电子式表示H物质的形成过程
(2)电解池①中的阴极产物的名称
(3)足量的E与P溶液反应生成J,离子方程式为
(4)N溶液呈碱性,用离子方程式解释原因
(5)请模仿上述物质转化关系图设计F→K的最佳途径:(用A~N中的物质的化学式表示)
 |
F —→K
按设计得到1molK,至少需要另加的试剂及其物质的量是
n( )="" mol;n( )="" mol。
用下图装置可以进行测定SO2转化成SO3的转化率的实验。已知SO3的熔点是16.8℃,沸点是44.8℃。已知发生装置中所涉及反应的化学方程式为:
Na2SO3(s) + H2SO4(85%)==Na2SO4 + H2O + SO2↑
 |
(1)根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置。请从下图A~E装置中选择最适合装置并将其序号填入下面的空格中。
Ⅰ、Ⅱ、Ⅲ处连接的装置分别是 _______、 _____、 _______。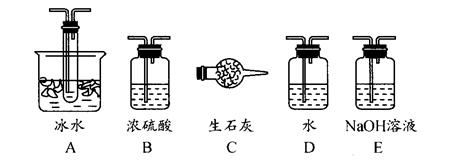
(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验中在加热催化剂与滴加浓硫酸的顺序中,应采取的操作是。若用大火加热烧瓶时,SO2的转化率会(填“升高”、“不变”或“降低”)
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象不明显,但又不存在气密性问题,请你推测可能的原因并说明相应的验证方法(可以不填满)。
①原因,验证方法
②原因,验证方法
③原因,验证方法
(4)将SO2通入含1.5mol氯酸的溶液中,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式
(5)用amolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅲ增重了bg,则实验中SO2的转化率为%(用含a、b的代数式填写)
有二价金属的硝酸盐晶体,化学式为M(NO3)x·nH2O,经测定式量为242,将2.42g该晶体溶于水配成200ml溶液,将此溶液置于装有隋性电极的电解池中进行电解,若有0.02mol电子转移给金属离子时,溶液中金属离子全部析出,经称量阴极增重0.64g,试计算:
①金属M的相对原子质量,及x的值.
②若忽略溶液体积变化,则电解后溶液的PH值为多少?