在体积为1L的两个恒容密闭容器中,分别充入1molCO和1molH2O(g)的混合气体,进行如下化学反应:CO(g)+H2O(g)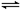 CO2(g)+H2(g),反应物CO的物质的量在不同温度时物质的量随时间的变化如下表所示,回答下列问题:
CO2(g)+H2(g),反应物CO的物质的量在不同温度时物质的量随时间的变化如下表所示,回答下列问题:
| |
0min |
10min |
20min |
30min |
40min |
50min |
| 830℃ |
1mol |
0.8mol |
0.65mol |
0.55mol |
0.5mol |
0.5mol |
| 1100℃ |
1mol |
0.75mol |
0.6mol |
0.6mol |
0.6mol |
0.6mol |
(1)1100℃时,前10min该反应的化学反应速率v(CO2)= ,830℃平衡后CO转化率的为__________________。
(2)1100℃时化学平衡常数K=_______,该反应为________反应(填“吸热”和“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是____________________。
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O) (d)c(CO2)=c(CO)
(4)1100℃时达到平衡后,若向容器中再充入2molCO和2molH2O(g),平衡_____________________移动(选填“向正反应方向”或“向逆反应方向”或“不”),再达到平衡时,H2百分含量________________(选填“增大”或“减小”或“不变”)。
(5)830℃时,若在体积为2L的密闭容器中充入1molCO2和1molH2的混合气体,60min时反应达平衡状态,画出c(CO)和c(H2)随时间变化而变化的趋势图。
(12分)某短周期元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应:甲+乙 丙+丁+水。
丙+丁+水。
(1)若丙为NO2。①甲与乙反应的化学方程式为 。
。
②NO2可作火箭重要燃料—肼(N2H4)的助燃剂。已知:
N2(g) + 2O2(g)=2NO2(g)△H= +67.7 kJ·mol-1,
2N2H4(g) + 2NO2(g)=3N2(g) + 4H2O(g)△H=-1135.7 kJ·mol-1。
写出燃料—肼(N2H4)燃烧生成氮气和水蒸气的热化学方程式: 。
。
(2)若丙为SO2。
①把乙滴入硫酸铜晶体,观察到的现象是。
②SO2能使酸性KMnO4溶液紫红色褪去,完成下列离子方程式: MnO4- +
MnO4- +  SO2 +
SO2 +  =
=  Mn2+ +
Mn2+ +  SO42- +
SO42- +  H+
H+
③SO2在一定条件下,发生:2SO2(g)+O2(g) 2SO3(g)△H< 0反应。该反应的化学平衡常数K=(填表达式);反应达平衡时,若改变其中一个条件x,则符合图中曲线的是(填序号)。
2SO3(g)△H< 0反应。该反应的化学平衡常数K=(填表达式);反应达平衡时,若改变其中一个条件x,则符合图中曲线的是(填序号)。
a.x表示温度,y表示SO2的物质的量
b.x表示压强,y表示SO2的转化率
c.x表示SO2的物质的量,y表示O2的物质的量
d.x表示SO3的物质的量,y表示化学平衡常数K
16分)现有六种短周期元素A、B、C、D、E、F,其原子序数依次增大,其中B与C、D与F分别位于同一周期,A与D、C与F分别位于同一主族,且A、D两元素原子的质子数之和是C、F两元素原子质子数之和的一半。又知六种元素所形成的常见单质在常温常压下三种是气体,三种是固体。请回答下列问题:
(1)D离子的结构示意图;
F元素氧化物的晶体类型为。
(2)比较B、C、D元素简单离子半径的大小:>>(填微粒符号)
(3)请说出C的氢化物比F的氢化物稳定的根本原因:;
用高能射线照射液态水时,一个A2C分子能释放出一个电子,同时产生一种具有较
强的氧化性的阳离子,试写出阳离子的电子式:,该阳离
子中存在的化学键有,并写出该阳离子与F氢化物的水溶
液反应的离子方程式:。
(4)E是金属元素,且E单质可以与空气中的N2、CO2等反应 ,E的最高价氧化物的水化物难溶于水,已知298K时,该难溶物质的的KSP=5.6×10-12,若此时测得溶液pH
,E的最高价氧化物的水化物难溶于水,已知298K时,该难溶物质的的KSP=5.6×10-12,若此时测得溶液pH
=13.00,则此温度下残留在溶液中的E离子物质的量浓度为mol·L-1。
现有铁和铜组成的合金共a mol,其中铜的物质的量分数为x。将此合金研成粉末状后全部投入含b mol硝酸的稀溶液中,微热使其充分反应,硝酸的还原产物只有NO。
(1)用粒子符号填写下列空白(列举出全部可能出现的情况):
| 组序 成分 |
① |
② |
③ |
④ |
⑤ |
⑥ |
| 残留固体成分 |
[ |
|||||
| 溶液中金属离子 |
(2)当溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围为(用a、x表示)
(3)当x=0.5时,溶液中Fe3+和 Fe2+的物质的量相等,在标准状况下共生成672毫升NO气体,求a和b的值。
现有浓度各为2 mol/L的FeCl3、FeCl2、CuCl2混合溶液100 mL,加入一定量的铁粉,按下列情况填空。
(1)充分反应后,无固体存在,则溶液中一定含有的金属阳离子是。
(2)反应完毕后,铁粉有剩余,过滤所得的固体物质为,溶液中一定含有的金属离子的物质的量为mol。
(3)反应完毕,有固体剩余,则反应后的溶液中一定有的金属阳离子为,其物质的量取值范围是。
A-I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。已知H为主族元素的固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素在元素周期表中位置
(2)写出C、H物质的化学式:C; H
(3)写出反应①、⑥的化学方程式和③、⑦的离子方程式:
反应①:
反应⑥:
反应③:
反应⑦:
(4)反应⑥过程中的现象是。