阿司匹林( )是应用最早、最广和最普通的解热镇痛药。科学家通过乙二醇把阿斯匹林连接在高聚物F上,制成缓释长效阿斯匹林(
)是应用最早、最广和最普通的解热镇痛药。科学家通过乙二醇把阿斯匹林连接在高聚物F上,制成缓释长效阿斯匹林( )。
)。
高聚物F的合成路线如下:
(1)阿司匹林中含有的官能团名称 。
(2)A的名称为 B的结构简式为_____________ 。
(3)阿斯匹林连接在高分子载体上的有机反应类型是 ; D→E的反应类型是 。
(4)写出B→C反应的化学方程式:___________________ ;
写出E→F反应的化学方程式:___________________ 。
(5)阿司匹林可由水杨酸(C7H6O3)跟乙酸酐在催化剂作用下生成,满足以下条件的水杨酸的同分异构体有多种,写出其中任一种的结构简式 。
①分子中有苯环;②能发生银镜反应;③苯环上的一硝基取代物有2种。
甲、乙、丙、丁、戊五种单质在一定条件下反应生成A、B、C、D、E五种化合物,其转化关系如图所示。又知:①甲、乙、丙、丁均为前三周期元素的单质,常温下均为气态,丙、丁是空气的主要成分,戊是应用最广泛的金属。②乙在甲中燃烧发出苍白色火焰,E的水溶液呈黄色。回答下列问题:
(1)A与B可反应,产物中阳离子的结构式为。
(2)A与B的沸点比较,较高的是(写化学式)。
(3)E的水溶液可使KI淀粉溶液变蓝,写出该反应的离子方程式:。
(4)工业上可由B与丁反应制取C,写出该反应的化学方程式:。
(5)将甲和E同时加(通)入强碱性溶液中,可制得一种高效杀菌、净水剂(其中含由+6价戊元素形成的带2个单位负电荷的含氧酸根离子),请写出该反应的离子方程式:。
(6)用以上金属戊作电极,利用如图装置,可以模拟金属的电化学防护。若X为碳棒,为减缓戊的腐蚀,开关K应置于处。若X为锌,开关K置于M处,该电化学防护法称为。
几种中学化学常见的单质及其化合物相互转化的关系图如下: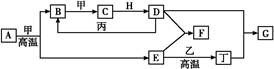
可供参考的信息有:
①甲、乙、丙、丁为单质,其余为化合物。A、E、F、G四种物质中含同种元素。
②A由X和Y两种元素组成,其原子个数比为1∶2,元素质量之比为7∶8。
③B气体是引起酸雨的主要物质,H常温下为无色无味的液体,E常用作红色油漆和涂料。
试根据上述信息回答下列问题:
(1)A的化学式为,每反应1 mol的A转移的电子为mol;
(2)F与丁单质也可以化合生成G,试写出该反应的离子方程式:;
(3)少量F的饱和溶液分别滴加到下列物质中,得到三种分散系①、②、③。
试将①、②、③三个序号以及对应的分散质具体的化学式填入下列方框中: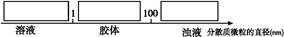
(4)化合物M与H组成元素相同,可以将G氧化为F,且不引进新的离子。试写出M在酸性环境下将G氧化为F的离子方程式:。
某固体混合物含NH4I、NaHCO3、AlCl3、MgBr2、FeCl2中的几种,为确定该固体混合物的成分及各组成成分的物质的量之比,现进行如下实验。
实验Ⅰ:
(1)无色气体为。
(2)该固体混合物的成分为。
实验Ⅱ:取一定量的该固体混合物溶于水配成1 L溶液,并向该混合溶液中通入一定量的Cl2,测得溶液中几种阴离子(分别用A-、B-、C-表示)的物质的量与通入Cl2体积的关系如表所示。
| Cl2的体积 (标准状况下)/L |
2.8 |
5.6 |
11.2 |
| n(A-)/mol |
1.25 |
1.5 |
2 |
| n(B-)/mol |
1.5 |
1.4 |
0.9 |
| n(C-)/mol |
a |
0 |
0 |
(3)a=。
(4)原固体混合物中各组成成分的物质的量之比为。
配制500 mL 0.5 mol/L的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为。
(2)配制方法:设计五个操作步骤。
①向盛有NaOH固体的烧杯中加入200 mL蒸馏水使其溶解,并冷却至室温;
②继续往容量瓶中加蒸馏水至液面接近刻度线1~2 cm;
③将NaOH溶液沿玻璃棒注入500 mL容量瓶中;
④用少量的蒸馏水洗涤烧杯和玻璃棒2~3次,然后将洗涤液移入容量瓶;
⑤改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
试将操作步骤正确排序。
(3)某学生实际配制NaOH溶液的浓度为0.48 mol/L,原因可能是。
| A.使用滤纸称量氢氧化钠固体 |
| B.容量瓶中原来存在少量蒸馏水 |
| C.溶解后的烧杯未经多次洗涤 |
| D.胶头滴管加水定容时仰视刻度线 |
下列框图涉及的物质所含元素中,除一种元素外,其余均为1~18号元素。
已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出)。请回答下列问题:
(1)D的化学式为 ;F的结构式为 。
(2)A与B反应的化学方程式为 。
(3)E与G的稀溶液反应的离子方程式为 。
(4)B和C反应的化学方程式为 。
(5)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式 。