【化学-化学与技术】
工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g) 2NH3(g);△H=-92.44 kJ/mol;其部分工艺流程如下:
2NH3(g);△H=-92.44 kJ/mol;其部分工艺流程如下: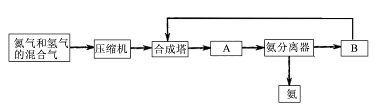
(1)合成氨所需要的原料气中,氮气取自 ,氢气来源于 。
(2)对原料气进行净化处理的目的是 。
(3)设备A的名称是 ,设备B的名称是 。
(4)在10~30Mpa时,工业合成氨选择400~500 ℃的温度进行反应,主要原因是 。
(5)据《科学》杂志报道,希腊化学家在常压下将氢气和用氢气稀释的氮气分另通入一个加热到570 ℃的电解池(如图)中,氢和氮在电极上合成了氨,且转化率达到了78%。
则阳极反应为 ,阴极反应为 。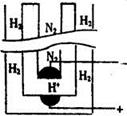
合成气(CO和H2)是重要的化工原料,在工业生产中有着广泛的应用。
(1)工业上用甲烷和水蒸气在高温条件下发生反应制备合成气(CO和H2),4g甲烷完全反应吸收51.5KJ热量,写该反应的热化学方程式
(2)工业上常用合成气来冶炼金属,其中CO还原氧化铁来冶炼生铁方程式如下:
3CO(g)+Fe2O3(s) 3CO2(g)+ 2Fe(s)△H<0
3CO2(g)+ 2Fe(s)△H<0
①如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,。
| A.容器中Fe2O3的质量不随时间而变化 | B.反应物不再转化为生成物 |
| C.n (CO) :n (CO2) = 1:1 | D.容器中气体的压强不随时间而变化 |
②在一个容积为4L的密闭容器中,1000℃时加入4mol CO(g)和足量Fe2O3(s),反应2分钟后达到平衡,测得此时容器内气体的密度为40g/L,求该时间范围内反应的平均反应速率υ(CO2)= ___、CO的平衡转化率= _____、该反应的化学平衡常数K=。
(1)利用盖斯定律可以从已经精确测定的反应热效应来计算难于测量或不能测量的反应的热效应。已知:N2(g)+ 2O2(g)="=" 2NO2(g) ΔH=" +67.7" kJ·mol-1,
N2H4(g)+ O2(g)="=" N2(g)+ 2H2O(g) ΔH=" -534" kJ·mol-1。
请写出气态肼与NO2气体完全反应生成氮气和水蒸气的热化学方程式:。
(2)已知:N≡N的键能是946kJ·mol-1,H—H的键能为436kJ·mol-1,N—H的键
能为393kJ·mol-1,计算合成氨反应生成1molNH3的△H=kJ·mol-1。
(3)现有25℃、pH=13的Ba(OH)2溶液,
①该Ba(OH)2溶液的物质的量浓度为________
②加水稀释100倍,所得溶液中由水电离出c(OH-)=____________
③与某浓度盐酸溶液按体积比(碱与酸之比)1 : 9混合后,所得溶液pH=11,该盐酸溶液的pH=________。
(4)回答醋酸与氢氧化钠反应的有关问题
①将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈(填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=” 或“<” )。
②pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈,溶液中c(Na+)
c(CH3COO-) .
③物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈,醋酸体积氢氧化钠溶液体积。
如图所示,U形管内盛有100mL的溶液,按要求回答下列问题: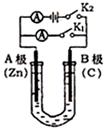
(1)打开K2 ,合并K1,若所盛溶液为CuSO4溶液:则A为极, A极的电极反应式为 。若所盛溶液为KCl溶液:则B极的电极反应式为
(2)打开K1,合并K2,若所盛溶液为滴有酚酞的NaCl溶液,则:
①A电极附近可观察到的现象是,Na+移向极(填A、B)
②B电极上的电极反应式为,
总反应化学方程式是 。
③反应一段时间后打开K2,若忽略溶液的体积变化和气体的溶解,B极产生气体的体积(标准状况)为11.2mL,将溶液充分混合,溶液的pH约为 。若要使电解质溶液恢复到原状态,需向U形管内加入或通入一定量的 。[ pH=-lgc(H+) ]
下列四种装置中,均盛200mL的溶液。
①0.005 mol/LCuSO4溶液,②0.01 mol/LH2SO4,③ZnCl2溶液,④KCl溶液.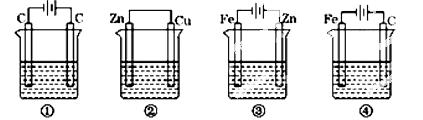
(1)上述四种装置中,为电解池的是(用编号回答),装置①中两电极的电极反应式分别是:阴极:,阳极:;
(2)若将装置④中的外加电源拆去,用导线将两个电极连接,则Fe极上发生的反应是___________________,C极上发生的反应是 。
(3)工作一段时间后,测得导线上均通过0.002mol电子,则上述装置②中生成气体的体积是________ mL (标准状况);
(1)已知:H2(g)+O2(g) H2O(g),反应过程中能量变化如图所示,则:
H2O(g),反应过程中能量变化如图所示,则: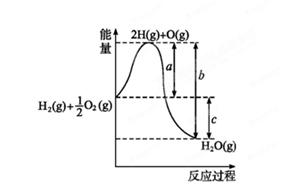
①试写出a、b、c分别代表的意义:
a ;
b ;
c 。
②该反应是反应(填“吸热”或“放热”),ΔH 0(填“>”或“<”)。
(2)发射“天宫”一号的火箭使用的推进剂是液氢和液氧,这种推进剂的优点是 , 。(请写两条)
(3)已知:H2(g)+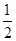 O2(g)=H2O(l) ΔH="-285.8" kJ·mol-1
O2(g)=H2O(l) ΔH="-285.8" kJ·mol-1
H2(g)==H2(l) ΔH="-0.92" kJ·mol-1
O2(g)==O2(l) ΔH="-6.84" kJ·mol-1
H2O(l)=H2O(g) ΔH="+44.0" kJ·mol-1
请写出液氢和液氧生成气态水的热化学方程式:。