如图所示,U形管内盛有100mL的溶液,按要求回答下列问题: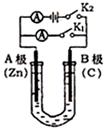
(1)打开K2 ,合并K1,若所盛溶液为CuSO4溶液:则A为 极, A极的电极反应式为 。若所盛溶液为KCl溶液:则B极的电极反应式为
(2)打开K1,合并K2,若所盛溶液为滴有酚酞的NaCl溶液,则:
①A电极附近可观察到的现象是 ,Na+移向 极(填A、B)
②B电极上的电极反应式为 ,
总反应化学方程式是 。
③反应一段时间后打开K2,若忽略溶液的体积变化和气体的溶解,B极产生气体的体积(标准状况)为11.2mL,将溶液充分混合,溶液的pH约为 。若要使电解质溶液恢复到原状态,需向U形管内加入或通入一定量的 。[ pH=-lgc(H+) ]
在2014年国家科学技术奖励大会上,甲醇制取低碳烯烃技术(DMTO)获国家技术发明奖一等奖。DMTO主要包括煤的气化、液化、烯烃化三个阶段。
(1)煤的气化:用化学方程式表示出煤的气化的主要反应________________________:
(2)煤的液化:下表中有些反应是煤液化过程中的反应:
①a__________0(填“>”、“<”、“=”),c与a、b之间的定量关系为__________。
②K3=__________,若反应③是在容积为2 L的密闭容器巾进行(500℃)的,测得某一时刻体系内 物质的量分别为6 mol、2 mol、10 mol、10 mol,则此时CH3OH的生成速率(填“>”、“<”、“=”) CH3OH的消耗速率。
物质的量分别为6 mol、2 mol、10 mol、10 mol,则此时CH3OH的生成速率(填“>”、“<”、“=”) CH3OH的消耗速率。
(3)烯烃化阶段:如图l是某工厂烯烃化阶段产物中乙烯、丙烯的选择性与温度、压强之间的关系(选择性:指生成某物质的百分比,图中I、Ⅱ表示乙烯,Ⅲ表示丙烯)。
①为尽可能多地获得乙烯,控制的生产条件为__________。
②一定温度下某密闭容器中存在反应,  。在压强为P1时,产物水的物质的量与时间的关系如图2所示,若t0时刻,测得甲醇的体积分数为10%,此时甲醇乙烯化的转化率为_________(保留三位有效数字),若在t1时刻将容器容积快速扩大到原来的2倍,请在图中绘制出此变化发生后至反应达到新平衡时水的物质的量与时问的关系图。
。在压强为P1时,产物水的物质的量与时间的关系如图2所示,若t0时刻,测得甲醇的体积分数为10%,此时甲醇乙烯化的转化率为_________(保留三位有效数字),若在t1时刻将容器容积快速扩大到原来的2倍,请在图中绘制出此变化发生后至反应达到新平衡时水的物质的量与时问的关系图。
一定条件下,在一容积为4 L的密闭容器中通入0.4 molN2和1.2 molH2,发生反应:N2(g)+3H2(g) 2NH3(g)△H<0;
2NH3(g)△H<0;
(1)当进行到第4分钟时达到平衡,生成NH3为0.4 mol,则从开始到达平衡时NH3的平均速率v(NH3)=_____________(注明单位)。
(2)该条件下,反应的平衡常数表达式K =______,若降低温度,K值将_____(填“增大”“减小”“不变”)
(3)达到平衡后,若其它条件不变,把容器体积缩小一半,平衡将_____移动(“向逆反应方向”、“向正反应方向”或“不”).
(4)在三个相同的容器中各充入1 molN2和3molH2,在不同条件下分别达到平衡,氨的体积分数随时间变化如图。下列说法正确的是。
a.图Ⅰ可能是不同压强对反应的影响,且P2>P1
b.图Ⅱ可能是不同温度对反应的影响,且T1>T2
c.图Ⅲ可能是同温同压下,催化剂性能,1>2
(5)常压下,把H2和用氦气(He)稀释的N2分别通入一个加热到570℃的电解池装置,H2和N2便可在电极上合成氨,装置中所用的电解质(图中黑细点)能传导H+,则阴极的电极反应式为____________________。
乙基香兰素是一种合成香料,其结构简式如图: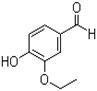
(1)以下推测正确的是;
a.从分子结构上看,它属于芳香烃
b.该物质能与FeCl3溶液发生显色反应
c.该物质能与碳酸钠溶液反应产生CO2气体
d.一定条件下,1mol该物质最多能与4molH2发生加成反应
(2)R物质是乙基香兰素的同分异构体,性质如下: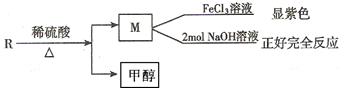
试写出任意一种符合上述条件的R的同分异构体的结构简式。
(3)X也是乙基香兰素的同分异构体,其可以发生如下反应: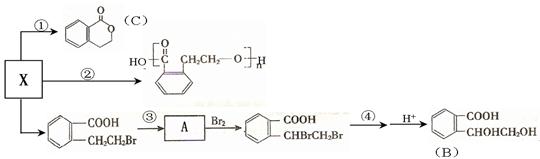
(Ⅰ)X的结构简式;B中含氧官能团的名称;
(Ⅱ)反应①的反应类型、化合物C的分子式为;
(Ⅲ)反应④的试剂是NaOH的水溶液;反应④的化学方程式为。
KMnO4是常见的试剂。
Ⅰ.某小组拟用酸性KMnO4溶液与H2C2O4(K1=5.4×10-2)的反应(此反应为放热反应)来探究“条件对化学反应速率的影响”,并设计了如下的方案记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20 mol/L H2C2O4溶液、0.010mol/L KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
| 物理量 编号 |
V(0.20 mol/LH2C2O4溶液)/mL |
甲 |
V(0.010mol/L KMnO4溶液)/mL |
M(MnSO4固体)/g |
T/℃ |
乙 |
| ① |
2.0 |
0 |
4.0 |
0 |
50 |
|
| ② |
2.0 |
0 |
4.0 |
0 |
25 |
|
| ③ |
1.0 |
a |
4.0 |
0 |
25 |
|
| ④ |
2.0 |
0 |
4.0 |
0.1 |
25 |
回答下列问题:
(1)完成上述反应原理的离子反应方程式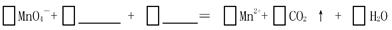
(2)上述实验①②是探究对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则表格中“甲”应填写,a为;乙是实验需要测量的物理量,则表格中“乙”应填写。
(3)上述实验②④是探究催化剂对化学反应速率的影响。
请在答题卷的坐标图中画出实验②和④的能量变化关系图(作必要的标注)。
Ⅱ.某化学小组利用下图装置进行实验证明氧化性:KMnO4>Cl2>Br2。限选试剂:KBr溶液、KMnO4、浓盐酸、浓硫酸
(4)装置a、d中盛放的试剂分别是:、;实验中观察到的现象为;此实验装置的不足之处是。
二甲醚具有优良的燃烧性能,被称为21世纪的“清洁能源”,以下为其中一种合成二甲醚的方法:在一定温度、压强和催化剂作用下,在同一反应器中进行如下反应:
①CO2(g)+3H2(g) CH3OH(g) +H2O(g)△H1=-49.1 kJ·mol-1
CH3OH(g) +H2O(g)△H1=-49.1 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g)△H2=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g)△H2=-24.5 kJ·mol-1
③CO2(g)+H2(g) CO(g)+H2O(g) △H3=+ 41.2 kJ·mol-1
CO(g)+H2O(g) △H3=+ 41.2 kJ·mol-1
(1)写出CO2(g)加H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式是。
(2)一定条件下,原料气中n(H2)/n(CO2)比值和温度对CO2转化率影响的实验数据如下图。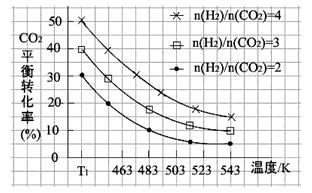
①温度为T1 K时,在1 L反应容器中投入2mol CO2 和8mol H2进行反应,试计算达到平衡时CO2的浓度为。
②结合数据图,归纳CO2平衡转化率受外界条件影响的变化规律:
a。
b。
(3)为研究初始投料比与二甲醚产率关系,在一定温度和压强下,投入一定物质的量的H2、CO、CO2进行试验,实验发现二甲醚的平衡产率随原料气中n(CO)/〔n(CO)+n(CO2)〕比值增大而增大,试分析其原因。
(4)下图是科学家现正研发的,以实现反应①在常温常压下进行的装置。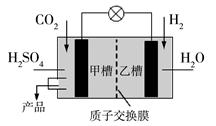
写出甲槽的电极反应。