甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); △H= +49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H= -192.9 kJ·mol-1
下列说法正确的是
| A.CH3OH的燃烧热为192.9 kJ·mol-1 |
B.反应①中的能量变化如图所示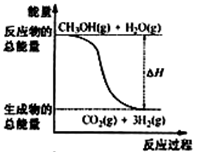 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
| D.根据②推知反应: CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1 |
下列化学反应,能用离子方程式H++OH-=H2O表示的是()
| A.澄清石灰水与盐酸反应 | B.氢氧化钡溶液和稀硫酸反应 |
| C.氢氧化镁和稀硝酸反应 | D.氢氧化铁溶液与盐酸反应 |
下列两种物质的溶液混合后不能发生离子反应的是()
| A.HNO3和Na2CO3 | B.NaCl和AgNO3 |
| C.K2SO4和BaCl2 | D.HNO3和BaCl2 |
下列叙述正确的是()
| A.固态氯化钾不导电,所以氯化钾不是电解质 |
| B.石墨能导电,所以石墨是电解质 |
| C.硫酸溶液能导电,所以硫酸是电解质 |
| D.CO2溶于水能导电,所以CO2是电解质 |
下列实验操作中,正确的是()
| A.利用丁达尔效应可以区分溶液和胶体 |
| B.用滤纸过滤可以除去溶液中的胶体粒子 |
| C.向氢氧化钠溶液中边滴加饱和FeCl3溶液边振荡制备Fe(OH)3胶体 |
| D.向Fe(OH)3胶体加入足量稀盐酸后,依然有丁达尔现象 |
分类是学习和研究化学的一种重要方法,下列分类合理的是()
| A.K2CO3和K2O都属于盐 | B.KOH和Na2CO3都属于碱 |
| C.H2SO4和HNO3都属于酸 | D.Na2O和Na2SiO3都属于氧化物 |