某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表。
| 实验操作 |
实验现象 |
| 1.用砂纸擦后的镁带与沸水反应,再向反应后溶液中滴加酚酞 |
(A)浮于水面,熔成一个小球,在水面上无定向移动,随之消失,溶液变红色 |
| 2.向新制的H2S饱和溶液中滴加新制的氯水 |
(B)产生气体,可在空气中燃烧,溶液变成浅红色 |
| 3.钠与滴有酚酞试液的冷水反应 |
(C)反应不十分强烈,产生的气体可以在空气中燃烧 |
| 4.镁带与2mol.L-1的盐酸反应 |
(D)剧烈反应,产生可燃性气体 |
| 5.铝条与2 mol.L-1的盐酸反应 |
(E)生成白色胶状沉淀,既而沉淀消失 |
| 6.向AlCl3溶液滴加NaOH溶液至过量 |
(F)生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告
(1)实验目的: 。
(2)实验用品:仪器:① ② ③ ④试管夹⑤镊子⑥小刀 ⑦玻璃片
⑧砂纸 ⑨滤纸 ⑩火柴等;
药品:钠、镁带、铝条、2 mol.L-1的盐酸、新制的氯水、饱和的H2S溶液AlCl3溶液、NaOH溶液等。
(3)实验内容:(填写与实验方案相对应的实验现象)
① ② ③ ④ ⑤ ⑥ (用A-F表示)
写出操作3反应的离子方程式
(4)实验结论:
黄铜矿(CuFeS2)是炼钢和炼铜的主要原料.在高温下灼烧生成二氰化二铁和氧化铜。三氧化二铁和氧化亚铜都是红色粉末.常用作颜料。某学校化学兴趣小组通过实验米探究一红色粉末是Fe2O3、Cu2O或两者的混合物。探究过程如下:
【查阅资料】Cu2O是一种碱性氧化物.溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
【提出假设】
假设1:红色粉末是Fe2O3。假设2:红色粉末是Cu2O。假设3:红色粉末是Fe2O3和Cu2O的混合物。
【设计探究实验】
取少量粉末放入足量稀硫酸中.在所得溶液中再滴加KSCN试剂。
(1)若假设1成立,则实验现象是。
(2)滴加KSCN试剂后溶液不变红色.某同学认为原同体粉末中一定不含三氧化二铁。你认为这种说法合理吗?。简述你的理由(不需写出反应的化学方程式):。
(3)若固体粉末未完全溶解,仍然有固体存在.滴加KSCN试剂时溶液不变红色.则证明原固体粉末是,写出发生的氧化还原反应的离子方程式:。
【探究延伸】
(4)经过实验分析.确定红色粉末为Fe2O3和Cu2O的混合物。实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经过查阅资料得知.在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
实验小组设汁如下实验方案:
①试剂1为.试剂2为. (填字母)
| A.氯水 | B.H2O2 | C.NaOH | D.CuO |
②固体X的化学式为。
③操作II为。
如图所示是在实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出。 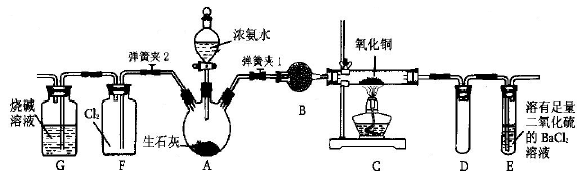
(l)在组装好装置后,若要检验A—E装置的气密性,其操作是: 首先 ,然后微热A,观察到E中有气泡冒出,移开酒精灯或松开双手,E中导管有水柱形成说明装置气密性良好。
(2)装置B中盛放试剂是。
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹1,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗,稍后片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时产生(答现象);从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式。
(4)当C中固体全部变红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量。若反应前固体质量为16g,反应后称重固体质量减少2.4g。通过计算确定该固体产物的成分是(用化学式表示)。
(5)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中。写出产生白烟的化学方程式 。
迅速产生倒吸的原因是。
某学习小组拟通过实验探究绿矾(FeSO4·7H2O)热分解的产物。
【实验前准备】
(1)理论分析小组成员从理论上分析,认为下列分解产物不可能的是。
a.Fe2O3、SO3、H2Ob.Fe2O3、SO2、SO3、H2O
c.FeO、Fe2O3、SO2、SO3、H2O
(2)查阅资料常压下SO3熔点16.8℃,沸点44.6℃
【实验探究】
针对以上可能的组合猜想,该学习小组设计如下图所示的实验装置(图中加热、夹持仪器等均省略):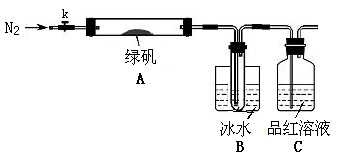
(3)实验过程
①仪器连接后,检查装置A与B气密性的操作为。
②取一定量绿矾固体置于A中,通入N2以驱尽装置内的空气,关闭k,用酒精灯加热
双通管。
③观察到A 中固体逐渐变红棕色,B中试管收集到无色液体,C中溶液褪色。
④待A中反应完全并冷却至室温后,取少量反应后固体于试管中,加入硫酸溶解,取
少量滴入几滴KSCN溶液,溶液变红色。
⑤往B装置的试管中滴入几滴BaCl2溶液,溶液变浑浊。
( 4)实验结果分析
结论1:B中收集到的液体是。
结论2:C中溶液褪色,可推知产物中有。
结论3:综合分析上述实验③和④可推知固体产物一定有Fe2O3。
【实验反思】
(5)请指出该小组设计的实验装置的明显不足:。
(6)分解后的固体中可能含有少量FeO,取上述实验④中盐酸溶解后的溶液少许于试管中,
选用一种试剂鉴别,该试剂最合适的是。
a.氯水和KSCN溶液 b.酸性KMnO4溶液 c. H2O2 d. NaOH溶液
某研究性学习小组做实验时偶然发现,表面擦去氧化膜的镁片可与NaHCO3溶液反应产生大量气体和白色不溶物。该小组同学通过如下实验,验证产物并探究反应原理。
实验①:用砂纸擦去镁条表面氧化膜,将其放入盛适量滴有酚酞试液的饱和碳酸氢钠溶液的烧杯中,迅速反应,产生大量气泡和白色不溶物,溶液的浅红色加深。
Ⅰ、定性实验
(1)气体的检验
实验②:将实验①中收集到的气体点燃,发现气体安静燃烧,火焰呈淡蓝色。则气体为。
(2)该小组同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为
猜测2:白色不溶物可能为MgCO3
猜测3:白色不溶物可能为碱式碳酸镁[yMg(OH)2•xMgCO3]
请设计一个实验检验固体中是否含有MgCO3,写出实验操作、现象和结论:。
(3)实验③:取实验①中的滤液,向其中加入少量CaCl2稀溶液,产生白色沉淀,溶液红色变浅,说明溶液中存在CO32-离子。
Ⅱ、定量实验
(4)为进一步确定实验I的白色不溶物的成分,进行以下定实验,装置如图所示: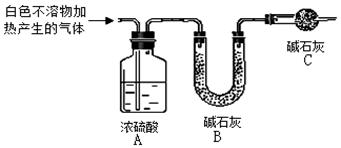
称取干燥、纯净的白色不溶物 7.36 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验后装置A增重0.72g,装置B增重2.64 g。白色不溶物的化学式为。
(5)写出镁与饱和碳酸氢钠溶液反应的化学方程式。
Ⅲ、反应原理分析
(6)NaHCO3溶液中存在如下电离平衡:H2O H+ + OH-、HCO3-
H+ + OH-、HCO3- H+ +CO32-,请从平衡移动角度分析实验①产生大量气体和白色不溶物的原因:。
H+ +CO32-,请从平衡移动角度分析实验①产生大量气体和白色不溶物的原因:。
某学生用0.1000 mol·L-1标准氢氧化钠溶液滴定未知浓度的稀硫酸,其操作可分解为如下几步:
| A.取20.00mL待测硫酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞试液 |
| B.用标准氢氧化钠溶液润洗滴定管2~3次 |
| C.把盛有标准氢氧化钠溶液碱式滴定管固定好,调节滴定管尖嘴使之充满溶液 |
| D.取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2~3mL |
E.调节液面至“0”或“0”刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,用标准氢氧化钠溶液滴定至终点并记下滴定管的读数
(1)正确操作步骤的顺序为(填序号);
(2)上述B步骤操作目的是;
(3)判断到达滴定终点的现象是;
(4)①达到滴定终点后发现碱式滴定管尖嘴部分有气泡,测定结果会(填“偏大”“偏小”或“无影响”,下同);
②取待测硫酸溶液的酸式滴定管用蒸馏水洗涤后没有用该硫酸溶液润洗,测定结果会;
(5)请在右边的方框内画出正在排气泡的碱式滴定管(仅画出刻度以下部分):
(6)完成3次平行实验,平均消耗标准氢氧化钠溶液体积为20.20mL,则待测液的物质的量浓度为mol·L-1。