2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的 ΔH=—99kJ·mol-1.请回答下列问题: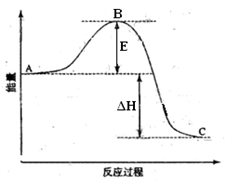
(1)图中A、C分别表示 、 ,
E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是
(2)图中△H= KJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式:
、
;
(4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1
,则υ(O2)= mol·L-1·min-1、
υ(SO3)= mol·L-1·min-1;
(5)已知单质硫的燃烧热为296 KJ·mol-1,求由S(s)生成3 molSO3(g)的△H= 。
写出下列物质的结构简式:
(1)2,4,6三甲基辛烷__________________________________________________;
(2)3甲基1丁炔 ____________________________________________________;
(3)间甲乙苯_________________________________________________________;
(4)苯乙烯___________________________________________________________.
某化合物的分子式为C5H11Cl,分析数据表明:分子中含有两个—CH3,两个—CH2—,一个CH和一个 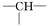 ,写出它可能的结构简式 ______________________
,写出它可能的结构简式 ______________________
已知下列有机物:
①CH3—CH2—CH2—CH3和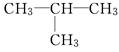
②CH2===CH—CH2—CH3和CH3—CH===CH—CH3
③CH3—CH2—OH和CH3—O—CH3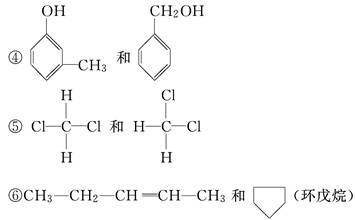
⑦CH2===CH—CH===CH2和CH3—CH2—C≡CH
(1)其中属于同分异构体的是________________.
(2)其中属于碳链异构的是________________.
(3)其中属于位置异构的是________________.
(4)其中属于官能团异构的是________________.
(5)其中属于同一种物质的是________________.
今有化合物: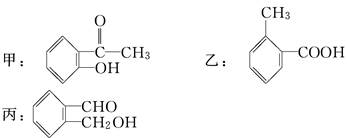
(1)请写出丙中含氧官能团的名称________.
(2)上述化合物中互为同分异构体的是________.
某学生写出如下十种一氯戊烷的同分异构体: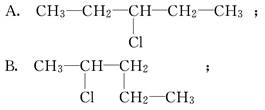
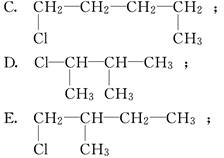
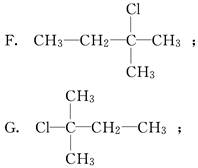
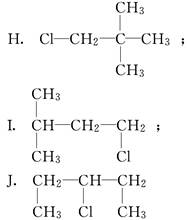
(1)你认为一氯戊烷共有________种同分异构体.
(2)上述十种结构中,属于同种分子的是______________________(填序号).