在标准状况下,下列物质的体积最大的是( )
| A.2gH2 | B.22gCO2 | C.23gNa | D.36gH2O |
合金是一类用途广泛和金属材料。下列物质属于合金的是
| A.石墨 | B.锌 | C.黄铜 | D.黄金 |
下列金属冶炼的反应原理,错误的是
A.2NaCl(水溶液)  2Na + Cl2↑ 2Na + Cl2↑ |
B.CuO + H2 Cu + H2O Cu + H2O |
C.Fe3O4 + 4CO 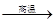 3Fe + 4CO2 3Fe + 4CO2 |
D.2HgO  2Hg + O2↑ 2Hg + O2↑ |
分液漏斗能用于互不相溶的两种液态物质的分离。能用分液漏斗进行分离的一组物质是
| A.硝酸和水 | B.乙醇和水 | C.乙酸乙酯和水 | D.乙酸和水 |
除去乙烷中乙烯的办法是
| A.点燃 | B.通过溴水 | C.通过浓硫酸 | D.通过石灰水 |
属于烃类的有机物是
| A.CH3COOH | B.CH2=CH2 | C.CH3CH2OH | D.CH3COOCH2CH3 |