硫酸是一种常见的强酸,你能写出稀硫酸与下列物质反应的离子方程式。
(1)铁________________________________________________________;
(2)氧化铜______________________________________________________;
(3)碳酸钠________________________________________________________;
(4)氢氧化钡溶液___________________________________________________;
(5)氯化钡溶液____________________________________________________。
I:某无色废水中可能含有H+、NH、Fe3+、Al3+、Mg2+、Na+、NO、CO、SO中的几种,为分析其成分,分别取废水样品100 mL,进行了三组实验,其操作和有关图像如下所示:
请回答下列问题:
(1)根据上述3组实验可以分析废水中一定不存在的离子有:。
(2)写出实验③图像中沉淀溶解阶段发生的离子反应方程式:。
(3)分析图像,在原溶液中c(NH )与c(Al3+)的比值为。NO
)与c(Al3+)的比值为。NO 是否存在?填(“存在”“不存在”或“不确定”)。
是否存在?填(“存在”“不存在”或“不确定”)。
II:现有A、B、C、D、E五种可溶性强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
| 阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 |
OH-、C1-、CO32-、NO3-、SO4- |
已知:
①A、B两溶液呈碱性;C、D、E溶液呈酸性;
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生;
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀;
④上述沉淀包括难溶物和微溶物。
试回答下列问题:
(1)A溶液呈碱性的原因是(用一个离子方程式表示)。
(2)D溶液是溶液,E溶液是溶液(均写化学式)。
(3)写出A溶液与E溶液反应的离子方程式:。
FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:
I:实验需要90mL 0.1mol/LFeBr2溶液
(1)配制FeBr2溶液除烧杯、玻璃棒、量筒、胶头滴管外还需的玻璃仪器是
(2)下列有关配制过程中说法正确的是(填序号)。
a.用托盘天平称量质量为1.94g的FeBr2
b.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏低
II:探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br- 被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+ 被Cl2氧化成Fe3+。
请你完成下表,验证假设:
| 实验步骤、预期现象 |
结论 |
| ①向溶液中加入适量CCl4,振荡、静置后 现象:__________________________; |
假设1正确 |
| ②向溶液中加入溶液 现象:。 |
假设2正确 |
若假设1正确,从实验①中分离出Br2的实验主要操作名称是;
(2)实验证明:还原性Fe2+ > Br-
请用一个离子方程式来证明:;
(3)若在50mL上述FeBr2溶液中通入5×10-3molCl2,则反应的离子方程式为:。
某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体,以探索工业废料的再利用。其实验方案如下:试回答下列问题: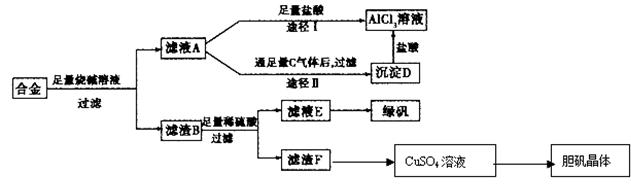
(1)器材已有:滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是(填名称)。
(2)由滤液A制得AlCl3溶液有途径I和Ⅱ两条,你认为合理的是____________。写出A经途径Ⅱ生成D的离子方程式。
(3)从滤液E中硫酸得到绿矾晶体的实验操作是。
(4)写出用滤渣F制备CuSO4溶液的化学方程式(要求节约,环保)。
(5)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否更合理,理由是
某澄清溶液,可能含有NH4+、Mg2+、Al3+、Na+、Cu2+、OH-、Cl-、I-、NO3-和SO42-等离子中的几种,现进行如下实验:
①在试管中取少许溶液,滴加几滴石蕊试液,溶液呈红色。
②另取原溶液少许,加入足量CCl4,在不断振荡的条件下加入足量氯水,静置,上层接近无色,下层呈紫红色。
③向②所得水溶液中加入AgNO3溶液,有白色沉淀生成。
④另取原溶液,滴加NaOH溶液,得白色沉淀;继续加入NaOH溶液至过量,沉淀部分溶解,过滤后给滤液加热,有刺激性气味的气体产生。
(1)由此判断原溶液中一定有大量的离子。
(2)步骤②反应的离子方程式是________________________________
(3)步骤④中沉淀溶解的离子方程式是
(4)还不能确定的阳离子是,如何检验?(写出实验名称及判断依据的现象)
____________________________________________________________________.
(8分) HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________(填序号)。
A.亚硝酸盐被还原B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是________(填序号)。
A.测定这两种溶液的pHB.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别 D.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:________________________。
(4) Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是________(填序号)。
A.Cl2B.FeC.H2O2D.HNO3