(1)现有73g某双原子分子气体,它的摩尔质量为36.5 g·mol—1。则:
① 该气体的物质的量为 mol。
② 该气体所含原子数为 NA。
③ 该气体在标况下的体积为 L。
④该气体完全溶于500mL水后稀释到2L,物质的量浓度为 mol·L—1。
(2)将100mL 0.5mol/L Na2SO4溶液加水稀释到500mL,稀释后:c(Na+)= mol·L—1。
(3) g H2O中的O原子数目与标准状况下2.24LCO2中的O原子数目相同。
(4分 )常温下,有pH=12的NaOH溶液10ml,要使它的pH降为11,
)常温下,有pH=12的NaOH溶液10ml,要使它的pH降为11,
(1)若加入蒸馏水,则加入蒸馏水的体积为___________ ml。
(2)若加入pH=3的HCl溶液,则加入HCl溶液的体积为_________________ ml。
写出下列物质的电离方程式:
(1)NaHSO4溶于水_______________________________________________________
(2)H2S的电离________________________________________________________
现有七种元素,其中A、 B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息
B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息 ,回答问题。
,回答问题。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B元素原子的核外p 电子数比s电子数少1 电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1="738kJ/mol" I2 =" 1451" kJ/mol I3 =" 7733kJ/mol" I4 = 10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(1)已知BA5为离子化合物,写出其电子式。
(2)B基态原子中能量最高的电子,其电子云在空间有个方向,原子轨道呈 形。
形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布为: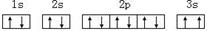
该同学所画的电子排布图违背了。
(4)G位于族区。
(5)DE3 中心原子的杂化方式为,用价层电子对互斥理论推测其空间构型为
中心原子的杂化方式为,用价层电子对互斥理论推测其空间构型为
(6)检验F元素的方法是,请用原子结构的知识解释产生此
现象的原因是
。
(7)F元素的晶胞如右图所示,若设该晶胞的密度为a g/cm3,阿伏加德罗常数为NA,F原子的摩尔质量为M,则F原子的半径为cm。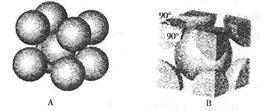
乙炔是有机合成工业的一种原料。工 业上曾用
业上曾用 与水反应生成乙炔。
与水反应生成乙炔。
(1) 中
中 与
与 互为等电子体,
互为等电子体, 的电子式可表示为;1mol
的电子式可表示为;1mol  中含有的
中含有的 键数目为_。
键数目为_。
(2)将乙炔通入 溶液生成
溶液生成 ,红棕色沉淀。
,红棕色沉淀。 基态核外电子排布式为。
基态核外电子排布式为。
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是;分子中处于同一直线上的原子数目最多为_。
(4) 晶体的晶胞结构与
晶体的晶胞结构与 晶体的相似(如右图所示),但
晶体的相似(如右图所示),但 晶体中含有的中哑铃形
晶体中含有的中哑铃形 的存在,使晶胞沿一个方向拉长。
的存在,使晶胞沿一个方向拉长。 晶体中1个
晶体中1个 周围距离最近的
周围距离最近的 数目为_。
数目为_。
X、Y、Z、Q、E五种元素中,X原子核外M层中只有两对成对电子,Y原子核外L层电子数是K层两倍,Z是地壳内含量(质量分数)最高元素,Q核电荷数是X与Z核电荷数之和,E电负性最大。
(1)相同条件下XZ2与YZ2分子在水中溶解度较大是,理由是
;
(2)Q的外围电子排 布为,在形成化合物时它的最高化合价为;
布为,在形成化合物时它的最高化合价为;
(3)在测定E的气态氢化物的相对分子质量时,实验测得的值一般高于理论值的主要原因是:。