A—J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已知A是一种高熔点物质,D是一种红棕色固体。
请回答下列问题:
(1)固体A的晶体类型为___________,K的化学式为 。
(2)C与D在高温下的反应在冶金工业上称为 反应,引发该反应的实验操作是_____ ______。
(3)G→J的化学方程式为____________。
(4)A→H的离子方程式为 。
(5)I的水溶液pH_____7(填“>”、“<”或“=”),原因是____(用离子方程式表示)。
我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸的反应为:S+2KNO3+3C==K2S+N2↑+3CO2↑。该反应中,KNO3被 (填“氧化”或“还原”),该反应中的氧化剂是 ;若消耗1mol S,则生成 mol N2,这些N2的质量是 ,在标准状况下的体积是 。
S元素在自然界的转化对环境有着重要的影响。
(1)汽车尾气与燃煤烟气中含有的SO2是造成酸雨的主要原因之一。
① 图中A的化学式是 。
② 硫酸型酸雨对大理石石像腐蚀的化学方程式是 。
(2)煤炭中以FeS2形式存在的硫,可用微生物脱硫技术脱去,有关反应的离子方程式依次为:
ⅰ.2FeS2+7O2+2H2O  4H++2Fe2++____________;
4H++2Fe2++____________;
ⅱ.4Fe2++O2+4H+ 4Fe3++______________;
4Fe3++______________;
ⅲ.FeS2+2Fe3+ 3Fe2++2S;
3Fe2++2S;
ⅳ.2S+3O2+2H2O  4H++2SO42-。
4H++2SO42-。
已知:FeS2中的铁元素为+2价。
回答下列问题:
① 将上述ⅰ、ⅱ离子方程式补充完整。
② 在线桥 上标出反应ⅲ中电子转移的数目:FeS2+2Fe3+
上标出反应ⅲ中电子转移的数目:FeS2+2Fe3+
③ 观察上述反应,FeS2中的S元素最终转化为_____________从煤炭中分离出来。
(3)生物质混煤燃烧是当今能源燃烧利用的最佳方式之一。燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2。你认为反应物除SO2、NaCl外还有 ,判断的理由是 。
(4)另一种烟气脱硫技术是石灰法,即在煤燃烧时加入生石灰(CaO)即可除去SO2,最后生成CaSO4,请写出该化学方程式: 。并计算在10 kg 含硫 1.6% 的煤中理论上加入 kg生石灰合适。
经检测某工厂的酸性废水中所含离子及其浓度如下表所示:
| 离子 |
Fe3+ |
Cu2+ |
SO42- |
Na+ |
H+ |
| 浓度/(mol/L) |
2×10-3 |
1×10-3 |
1×10-2 |
2×10-3 |
(1)c(H+)= mol/L。
(2)为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾(FeSO4·7H2O)。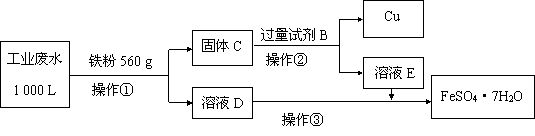
① 工业废水中加入铁粉后,反应的离子方程式为:
Fe + Cu2+ ="=" Fe2+ + Cu、 、 。
② 试剂B是 。
③ 操作③是蒸发浓缩、冷却结晶、 ,最后用少量冷水洗涤晶体,在低温下干燥。
④ 通过检验溶液D中Fe3+来判断废水中Fe3+是否除尽,实验方法是 。
⑤ 获得的FeSO4·7H2O需密闭保存,原因是 。
⑥ 上述1000 L废水经处理,可获得 FeSO4·7H2O的物质的量是 mol。
用铜屑制取硫酸铜溶液的一种方法是:将铜屑放入一定浓度的硫酸中,加热并不断鼓入空气,其反应原理为2Cu+O2+2H2SO4="=" 2CuSO4+2H2O。其中,还原剂是__________(填化学式),被还原的物质是__________(填化学式),若制备时用2 mol Cu与足量的O2和H2SO4反应,可制得_________mol CuSO4 。
(1)在25℃条件下将pH=10的氨水稀释10倍后溶液的pH为(填序号)________。
A.9 B.11 C.9~10之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,溶液pH_________(填“增大”、“减小”或“不变”),主要原因是________________。
(3)已知某溶液中只存在NH4+、H+、OH-、Cl-四种离子,该溶液中各离子浓度大小顺序可能有如下几种关系:
A.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
①上述离子浓度大小关系不可能的是_________(填序号)。
②若溶液中只溶解了一种溶质,则该溶质是____________,上述离子浓度大小顺序关系中正确的是(选填序号)________________。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl) ________ c(NH3·H2O)(填>、<或=)
(4)25℃时,如果将0.1molNH4Cl和0.05molNaOH溶于水,形成混合溶液,(假设无气体逸出损失),则NH4+和NH3·H2O两种粒子的物质的量之和等于________mol。