在①35Cl、②37Cl—、③12C、④23Na+、⑤24Mg2+、⑥14C中;(用序号回答下列问题)
(1)粒子半径比较:①_____②;④_____⑤(填 < = > 号)
(2)微粒中质子数等于中子数的是____________,核外电子数相等的微粒______ ______;
(3)_________与_________互为同位素,共有___________种元素。
有A、B、C、D、E五种短周期元素,其中A元素和B元素的原子都有一个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4;E元素的基态原子核外有六种运动状态的电子。请回答下列问题:
(1)A元素的简单离子基态时的电子排布式为R是由C元素与氢元素两种元素形成的18电子分子,R的电子式为
(2)CB3分子的空间构型是,其中心原子的杂化类型是
(3)由D、E、C三元素可形成共价化合物(DEC)2(分子中各原子均达8电子稳定结构),每个分子中含个δ键。
(4)E的一种低价氧化物与充入二氧化碳的空气和熔融碳酸钾可构成燃料电池。则该燃料电池的负极反应为正极反应为
(5)1.2gE的单质在标准状况下的1.68L氧气中燃烧,至反应物耗尽,放出X KJ热量。则1molE与O2反应生成E的低价氧化物时的热化学方程式为(已知:E的燃烧热为Y KJ/mol)
中国尿素合成塔(尿塔)使用寿命仅为欧美国家的1/4。为此北京钢铁研究 院对四川泸天化尿塔腐蚀过程进行研究,得出下列腐蚀机理: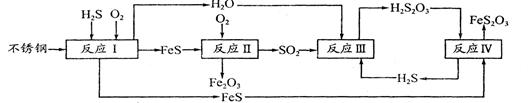
(1)H2S来自合成尿素的天然气。在380 K、体积为2 L的密闭容器中,存在如下反应:H2(g)+S(s) H2S(g)△H=+21.6kJ·mol-1。反应达到平衡时H2、S、H2S的物质的量均为3 mol,则380 K时该反应的化学平衡常数为______;下列对该反应分析正确的是______(填字母序号)。
H2S(g)△H=+21.6kJ·mol-1。反应达到平衡时H2、S、H2S的物质的量均为3 mol,则380 K时该反应的化学平衡常数为______;下列对该反应分析正确的是______(填字母序号)。
(2)在反应I中发生的化学反应为______。
(3)研究发现反应II是分别以Fe、FeS为电极,以水膜为电解质溶液的电化学腐蚀,其 负
极为______;
已知:Fe(s)+S(s)=FeS(s)△H1=-2.5akJ·mol-1
S(s)+O2(g)=SO2(g)△H2=-5akJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s)△H3=-6akJ·mol-1
则反应II的热化学方程式为_____
(4)已知H2S2O3的K1=2.2×10-1、K2=2.8×10-2。Na2S2O3水溶液呈______性,该溶液中电荷守恒式为_____;反应IY的反应类型为______;该反应______(填“能”或“不能”) 说明FeS溶解性强于FeS2O3
(5)泸天化尿塔的最终腐蚀产物为______;为了有效防腐,北钢建议泸天化在生产中用 CuSO4溶液“脱硫(H2S)”,其中涉及的离子方程式为
__________________
我国高校目前联合研究一种稀土制冷材料,其主要成分是LaCaMnO。
(1)锰原子的基态价层电子排布式为______
(2)S与O为同主族元素,其中电负性较大的是____________;H2S分子中S原子杂化轨道类型为______;试从结构角度解释H2SO4的酸性大于H2SO3的酸性:_______。
(3)据报道,Ca在空气中点燃生成CaO和少量Ca2N2。
①Ca2N2和水反应生成NH2-NH2,NH2—NH2能否作配体?______(填“能”或“否”)
②CaO形成的晶体与NaCl晶体一样,为面心立方最密堆积,则一个CaO晶胞中含 有Ca2+数为______ ;欲比较CaO与NaCl的晶格能大小,需考虑的数据是______。
已知A、B、C、D、E五种短周期元素,A的最外层电子数是其电子层数的3 倍,A、B同主族,C在短周期主族元素中原子半径最大,E2是黄绿色气体,D为金属元素,其单质可以用于工业冶炼Fe。
(1)D在周期表中的位置是______;
A、B、C离子半径由大到小的顺序为______。(用离子符号回答)
(2)工业上用E的单质制备漂白粉的化学方程式为
__________;
将少量C2A2加入水中可观察到的实验现象是;向所得溶液中加入酚酞可观察到溶液先变红后褪色,由此说明溶液中有______(填化学式)两种物质生成。
(3)D与Fe2O3的反应还可以用于定向爆破,其化学反应方程式为
_____;
该反应为______(填“吸热”或“放热”)反应。
(4)常温下,将0.0025 mol的BA2E2溶于水配成0.1L溶液,所得溶液的pH= 1,则 BA2E2与水反应的化学方程式为____________。
制备偶氮染料F和医药中间体Y的流程图如下:
已知: (1)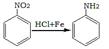
(2)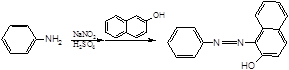 。
。
回答下列问题:
(1)写出反应类型:①;②。
(2)写出D→E反应的化学方程式。
(3)写出化合物A、F的结构简式。A、F。
(4)设计A→D的目的是。
(5)写出满足下列条件的C的任意两种同分异构体的结构简式。
a.是苯的对位二取代产物; b.能发生银镜反应
(6)参照上述流程图设计从X到Y的合成路线。