燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等。
(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为 。
(2)将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g) + 6H2(g)  CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比[n(H2) / n(CO2)] |
500 K |
600 K |
700 K |
800 K |
| 1.5 |
45% |
33% |
20% |
12% |
| 2.0 |
60% |
43% |
28% |
15% |
| 3.0 |
83% |
62% |
37% |
22% |
①若温度升高,则反应的平衡常数K将 (填“增大”、“减小”或“不变”。下同);若温度不变,提高投料比[n(H2) / n(CO2)],则K将 。
②若用甲醚作为燃料电池的原料,请写出在碱性介质中电池负极的电极反应式
。若通入甲醚(沸点为-24.9 ℃)的速率为1.12 L·min-1(标准状况),并以该电池作为电源电解2 mol·L-1 CuSO4溶液500 mL,则通电30 s后理论上在阴极可析出金属铜 g。
[化学—选修化学与技术]请回答有关氯碱工业的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=____(要求计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是________(填序号)
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
①图中X、Y分别是____、____(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_____;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:____;负极:____;③这样设计的主要节(电)能之处在于(写出2处)________、________。
合成氨对工、农业生产和国防都有重要意义。
已知:N2(g)+3H2(g)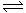 2NH3(g);△H= -92.4 kJ·mol-1,请回答:
2NH3(g);△H= -92.4 kJ·mol-1,请回答:
(1)合成氨工业中采取的下列措施可以用勒夏特列原理解释的是_____(填字母)。
a.用铁触媒(催化剂)加快化学反应速率
b.采用较高压强(20 MPa~50 MPa)
c.将原料气中的少量CO等气体净化除去
d.将生成的氨液化并及时从体系中分离出来
(2)一定温度下,在密闭容器中充入1 mol N2和3 mol H2并发生反应。
①若容器容积V恒定,达到平衡时,气体的压强为原来的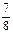 ,则N2的转化率а1=_____,此时,反应放热_____kJ;该温度下合成氨反应的平衡常数K=_____(只需列出数字表达式);
,则N2的转化率а1=_____,此时,反应放热_____kJ;该温度下合成氨反应的平衡常数K=_____(只需列出数字表达式);
②若容器压强恒定,则达到平衡时,容器中N2的转化率а2__а1(填“>、<或=”)。
(3)随着对合成氨研究的发展,希腊科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如下图)。钯电极A是电解池的____极(填“阳”或 “阴”),该极上的电极反应式是。
A、B、C、D、E是中学常见的5种化合物,A、B是氧化物。
Ⅰ、元素X、Y的单质是生活中常见的金属,相关物质间的关系如下图所示。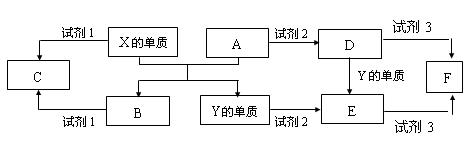
(1)X的单质与A反应的化学方程式是_____。
(2)若试剂1是NaOH溶液,X的单质与试剂1反应的离子方程式是_____。
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是_____。
②将物质C溶于水,其溶液呈酸性,原因是(用离子方程式表示)_____。
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是 。
Ⅱ、若X、Y是非金属单质,试剂3是NaOH溶液,F的水溶液可作木材的防火材料,则X的单质与A反应的化学方程式是__________,试剂1和C的化学式分别是_____、_____。Y在工业上的主要用途是________(写一种)。
【化学-有机化学基础】
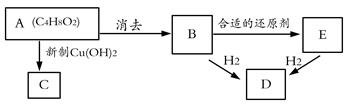
下图中,A无酸性,不能水解,在一定条件下发生消去反应可得到两种互为同分异构体的产物,其中的一种B含有一个甲基,可用于制取合成树脂、染料等多种化工产品。E能使溴水退色,不能发生银镜反应。
|
试回答下列问题;
【化学-物质结构与性质】
利用有关知识回答下列问题:
(1)B、F两元素形成的化合物的空间构型为,其中心原子的杂化类型为。
(2)CH4与(写微粒符号)互为等电子体。
(3)写出元素Cu基态原子的电子排布式。
(4)Fe与CO可形成的Fe(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于晶体(填晶体类型)。
(5)Zn的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为。
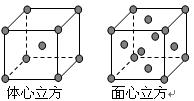
(6)金属Fe的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为。