前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子得到一个电子后3p轨道全充满;D最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,有F+和F2+两种离子。回答下列问题:
(1)元素电负性:D____E (填>、<或=)
(2)A、C单质熔点A_____C(填>、<或=)
(3)AE4中A原子杂化轨道方式为:________杂化;其固态晶体类型为_______
(4)F的核外电子排布式为______;向F的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出蓝色晶体,该晶体中F与NH3之间的化学键为_______
(5)氢化物的沸点:B比D高的原因______;
(6)元素X的某价态阴离子Xn-中所有电子正好充满K和L电子层,CnX晶体的最小结构单元如图所示。
该晶体中阳离子和阴离子个数比为_______,晶体中每个Xn-被_____个等距离的C+离子包围。
完成下列反应的离子方程式:
(1)向NaHSO4溶液中逐滴加入Ba(OH)2溶液,使原溶液中的SO42—恰好完全沉淀:
(2)向明矾溶液中逐滴加入Ba(OH) 溶液,当Al3+恰好全部沉淀时:
溶液,当Al3+恰好全部沉淀时:
(3)向Ca(HCO3) 2溶液中加入过量的NaOH溶液:
(5分)在HF、H2O、NH3、CH4、CO32-、CO2、HI分子中
(1)CO32-的价层电子对的空间构型为
(2)以极性键相结合,具有正四面体结构的非极性分子是。
(3)以极性键相结合,具有三角锥型结构的极性分子是。
(4)以极性键相结合,具有V型结构的极性分子是。
(5)以极性键相结合,而且分子极性最大的是。
钯(Pd)的性质与铂相似。工业上从废催化剂(主要成分是钯和活性炭,还含有少量铁、锌)中回收钯,采用如下流程:
请回答下列问题:
(1)酸溶I的目的是__________________________________。
(2)①酸溶Ⅱ时残渣与王水在加热条件发生的主要反应是:
3Pd +12HCl + 2HNO3  3H2PdCl4 + 2NO↑+ 4H2O
3H2PdCl4 + 2NO↑+ 4H2O
写出催化剂中另一主要成分与浓硝酸反应的化学方程式:_________________。
②酸溶Ⅱ需控制温度不宜过高,除了控制一定反应速率外,其原因可能还有
_____________________________。
③若用足量的烧碱吸收气体,请写出吸收后溶液中含有的溶质的化学式:NaOH、NaNO2、___________、___________。
(3)使用甲醛还原钯的化合物时,溶液须保持碱性,否则会造成甲醛的额外损耗,原因是_________。
(4)操作I的名称是_______________,溶液I可能含有的有机离子为________________。
(5)有人提出,在进行酸溶前最好先将废催化剂在700℃下进行灼烧,同时不断通入空气,
其目的是______________________________________________________。
请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)我国储氢纳米碳管研究已取得重大进展。用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
___C + ___K2Cr2O7 + _______=" ___" CO2↑ + ___K2SO4 + ___Cr2(SO4)3 +___H2O
请完成并配平上述化学方程式。
(2)工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+ 2H2(g)  CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
①下列措施中有利于增大该反应的反应速率的是____________。
| A.使用高效催化剂 | B.降低反应温度 |
| C.增大体系压强 | D.不断将CH3OH从反应混合物中分离出来 |
②在恒容容器中合成甲醇,当温度分别为230℃、250℃和270℃时,CO的转化率与n(H2)/n(CO)的起始组成比的关系如右图所示。已知容器体积1L,起始时CO的物质的量均为1mol。据此判断在上述三种温度中,曲线Z对应的温度是__________;利用图中a点对应的数据,计算该反应在对应温度下的平衡常数K =_______________________。
③已知: △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1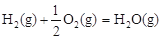 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气的热化学方程式为_________。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其溶度积常数Ksp=c(Ca2+)·c(CO32—)=2.8×10−9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10 -5 mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为________________________。
异戊二烯(即2-甲基-1,3丁二烯)是橡胶工业的重要原料。工业上有多种合成方法,其中两种如下:
根据题意回答下列问题:
(1)A的结构简式为______________。已知D可作为生产高分子导电材料的原料,则D
的名称是______________。
(2)反应①的反应类型是____________________。
反应②的化学方程式为_____________________________________________。
(3)下列说法正确的是_____________(填字母序号)。
A.1mol E完全燃烧耗6.5 mol氧气
B.A与B、E与F分别互为同系物
C.1mol异戊二烯与1mol Br2发生加成反应,产物不只一种
D.聚乙烯、聚异戊二烯均可以使溴的四氯化碳溶液褪色
(4)烯烃复分解反应可表示如下(炔烃也能发生此类反应):
写出CH2=CH—CH2—CH2—CH2—CH2—CH=CH2发生复分解反应生成六元环的化
学方程式:___________________________________________________________。
(5)与异戊二烯相差一个“CH2”原子团,且结构中只有一个甲基的同系物除 、
、 、
、 外,
外,
还有________________、_______________(填结构简式,已知 不稳定)。
不稳定)。