黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)冶炼铜的反应为: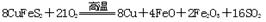
若CuFeS2中Fe的化合价为+2,反应中被氧化的元素是 (填元素符号)。
(2)上述冶炼过程产生大量SO2。下列处理方案中合理的是 (填代号)。
| A.高空排放 | B.用于制备硫酸 | C.用纯碱溶液吸收制Na2SO4 | D.用浓硫酸吸收 |
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82-+2I-=2SO42-+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程。
、 (不必配平)
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为: ①用稀盐酸浸取炉渣,过滤。 ②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
a.除去Al3+的离子方程式是 。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为 。
证明炉渣中含有FeO的实验现象为 。
下图是一种合成 路线:
路线:
已知以下信息:
①有机化合物A可用来衡量一个国家石油化学工业发展水平。
②有机化合物C的核磁共振氢谱显示其有3种不同化学环境的氢原子。
③
根据上述信息回答下列问题:
(1)A的结构式是 。
(2)B的结构简式为 。
(3)C生成D的化学方程式为 。
(4)反应Ⅱ的试剂是 ,该反应类型为 。
(5)在G的同分异构体中,既能与新制的Cu(OH)2悬浊液在加热条件下反应生成砖红色沉淀,又能与碳酸钠反应生成二氧化碳,还能使FeCl3溶液显色的有 种,所有这些同分异构体中,不同化学环境氢原子的种数 (填“相同”“不相同”)。
(每空2分,共10分)
I、火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量。反应的热化学方程式为 。
II、已知常温下在NaHSO3溶液中c(H2SO3 )<c(SO32-) 且H2SO3的电离平衡常数为:K1=1.5×10-2,K2=1.1×10-7;氨水的电离平衡常数为K=1.8×10-2;
(1)则等物质的量浓度的下列五种溶液:①NH3·H2O②KHSO3③KHCO3 溶液中水的电离程度由大到小排列顺序为 。
(2)0.1 mol·L-1的NaHSO3溶液中C(H+) C(OH-)(“>”、“<”或“=”):
Ⅲ、已知25 ℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33
(1)在25 ℃下,向浓度均为0.1 mol/L的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式)。
(2)溶液中某离子物质的量浓度低于1.0×10-5 mol/L时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2 mol/L。此时所得沉淀中________(填“含有”或“不含有”)Al(OH)3。
Ⅰ.有下列各组物质:
| A.O2和O3(臭氧) |
B. |
| C.CH3CH2CH2CH3和CH3CH(CH3)2 |
D. |
E.葡萄糖和果糖
F.(CH3)2CH2与C(CH3)4
G.淀粉和纤维素
H.液氯与氯气
(1) 组两物质互为同位素
(2) 组两物质互为同素异形体
(3) 组两物质属于同系物
(4) 组两组物质互为同分异构体
(5) 组中的物质是同一物质
(6)D中任意一者与氯气反应的一个化学方程式
Ⅱ.下图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合。
(1)图中属于烷烃的是 (填编号下同)属于烯烃的是 ,
(2)上图中与B互为同分异构体但不属于同种类的物质的是: 。
Ⅲ.某有机物气体含碳82.7%,含氢17.3%,在标准状况下它的密度是2.59g/L。
则(1)此有机物的相对分子质量为__________;
(2)此有机物的分子式为____________;其可能的结构简式为 。
某温度时,在2L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示。由图中数据分析:
(1)该反应的化学方程式: ;
(2)0~2min末,X的平均反应速率为 mol·L-1·min-1;
(3)3min后图中曲线所表示的含义是 。
有下列物质:①H2 ②Na2S2 ③KOH ④HF ⑤H2O2 ⑥MgCl2 ⑦NH4Cl,按下列要求,用圆圈数字(如:①、②、③等)填空:
(1)只由离子键构成的物质是________;
(2)只由极性键构成的物质是________;
(3)只由非极性键构成的物质是 ;
(4)只由非金属元素组成的离子化合物是 ;
(5)由极性键和非极性键构成的物质是___________;
(6)由离子键和极性键构成的物质是_____________;
(7)由离子键和非极性键构成的物质是___________。