甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如下图所示(某些条件和部分产物已略去)。下列说法不正确的是( )
| A.若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物 |
| B.若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2 |
| C.若丙、丁混合产生白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用 |
| D.若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为:甲 < 丙 < 戊 |
只用一种试剂可区别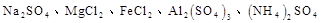 五种溶液, 这种试剂是()
五种溶液, 这种试剂是()
| A.Ba(OH)2 | B.H2SO4 | C.NaOH | D.AgNO3 |
制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu=2FeCl2+CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是烧杯中()。
| A.有铜无铁 | B.有铁无铜 | C.铁、铜都有 | D.铁、铜都无 |
下列离子方程式正确的是 ()
| A.铝粉投入到NaOH溶液中:2Al + 2 OH-= 2AlO2- + H2↑ |
| B.钠与硫酸铜溶液反应:Cu2+ + 2Na = 2Na+ + Cu |
| C.AlCl3溶液中加入足量的氨水:Al3++ 3 OH-= Al(OH)3↓ |
| D.Ba(OH)2溶液与H2SO4溶液反应:Ba2++2OH-+2H++SO42-=BaSO4¯+2H2O |
下列无色溶液中离子能大量共存,且加入OH-有沉淀析出,加入H+有气体放出的是 ( )
A.Fe3+、K+、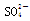 、 、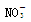 |
B.Na+、Ba2+、Cl-、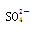 |
C.Na+、Ca2+、Cl-、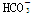 |
D.H+、Al3+、Cl-、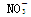 |
碳化钛(TiC)、碳化硼(B4C3)、氮化硅(Si3N4)等非氧化物陶瓷是新型无机非金属材料,合成这些物质需在高温条件下进行,在合成它们的过程中必须注意 ()
A.通入足量氧气 B.避免与氧气接触 C.通入少量氯气 D.通入少量氧气