(1)向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液会发
如下反应:Mn2++S2O82-+H2O→MnO4-+SO42-+H+
该反应常用于检验Mn2+的存在。其特征现象是_________________。
若反应中有0.1 mol还原剂参加反应,则消耗氧化剂物质的量__________mol。
(2)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有_________________。
(3)将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应:
NaBiO3+ MnSO4+ H2SO4— Na2SO4+ Bi2(SO4)3+ NaMnO4+ H2O
①配平上述反应的化学方程式,并标出电子转移的方向和数目;
②上述反应中还原产物是
针对以下A~D四个涉及H2O2的反应(未配平),填写空白
| A.Na2O2+HCl——H2O2+NaCl |
| B.Ag2O+H2O2——Ag+O2+H2O |
C.H2O2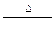 H2O+O2 H2O+O2 |
| D.H2O2+Cr2(SO4)3+KOH——K2CrO4+K2SO4+H2O |
(1)H2O2仅体现氧化性的反应是(填代号) 。
(2)H2O2既体现氧化性又体现还原性的反应是(填代号) 。
(3)H2O2体现弱酸性的反应是(填代号) ,其理由为 。
臭氧(O3)是一种有点腥气味的淡蓝色气体,它具有比氧气更强的氧化性。臭氧能使湿润的淀粉碘化钾试纸变蓝,反应中有氧气产生,这个反应的化学方程式是: ,这个反应的氧化产物是 ,还原产物是 。
如何用所提供的试剂和方法除去各粉末状混合物中的杂质(括号内为杂质)。将所选答案的编号填入在表内相应的空格内(如果不需要外加试剂,则对应答案栏可空着)。
1.可供选择的试剂:
| A.盐酸 | B.氢氧化钠溶液 | C.氧气 | D.水 E.二氧化碳 |
Ⅰ.可选用的操作:①水洗 ②加热 ③高温灼烧 ④过滤 ⑤结晶
漂白粉在潮湿的空气中易变质失效,请回答:存放环境中①有水蒸气无二氧化碳②有二氧化碳无水蒸气,哪种情况下漂白粉更易变质?为什么?
常温下 A 和 B 两种气体组成混合气体(A 的相对分子质量大于 B 的相对分子质量),经分析混合气体中只含有氮和氢两种元素,而且不论 A 和 B 以何种比例混合,氮和氢的质量比总大于 14/3。由此可确定 A 为_____________,B 为____________,其理由是__________________。
若上述混合气体中氮和氢的质量比为 7∶1,则在混合气体中 A 和 B 的物质的量之比为________;A 在混合气体中的体积分数为_____%。