实验室常用准确称量的邻苯二甲酸氢钾(结构简式如图所示)来准确测定NaOH标准溶液的浓度,即分析化学实验中常称为“标定”的一种方法。
已知:①NaOH溶液的浓度在0.1 mol·L-1左右,滴定终点时溶液的pH应为9.1。
②邻苯二甲酸氢钾相对分子质量为204
(1)写出邻苯二甲酸氢钾与NaOH反应的离子方程式________________________。
(2)将用托盘天平称好的邻苯二甲酸氢钾放于锥形瓶中,加适量的水溶解,溶液呈无色,
再加入指示剂______(从甲基橙、酚酞中选择),用NaOH溶液滴定到终点时,现象是____________。
某学生进行了四次实验,实验数据如下表:
| 实验编号 |
邻苯二甲酸氢钾的质量(g) |
待测NaOH溶液的体积(mL) |
| 1 |
0.4080 |
18.20 |
| 2 |
17.10 |
|
| 3 |
16.90 |
|
| 4 |
17.00 |
(3)滴定中误差较大的是第________次实验,造成这种误差的可能原因是____________。
A.碱式滴定管在装液前未用待测NaOH溶液润洗2~3次
B.滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
C.盛有邻苯二甲酸氢钾溶液的锥形瓶中有少量水
D.达到滴定终点时,俯视溶液凹液面最低点读数
E.滴定过程中,锥形瓶摇荡得太剧烈,以至有些液滴飞溅出来
F.滴定到终点时,溶液颜色由无色变到了红色
(4)该同学所测得的NaOH溶液的物质的量浓度为________ mol·L-1(结果保留三位小数)。
今欲用NaOH固体配制100mL 0.5mol/L的NaOH溶液。配制过程如下图所示:
请根据题意回答:
(1)配制该溶液应选用(填仪器)。
(2)用______(填滤纸或小烧杯)在托盘天平上称取_____ NaOH固体。
(3)向容量瓶中加入蒸馏水,如果超过了刻度线,应。
(4)配制好的溶液(填“能”或“不能”)长期存放在容量瓶中。
(5)以下因素会造成实验结果偏低的是
| A.容量瓶中原来有少量蒸馏水 | B.定容时观察液面俯视 |
| C.忘记洗涤 | D.定容时观察液面仰视 |
海藻中含有丰富的碘元素,碘元素通常以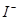 的形式存在。实验室从海藻灼烧后的海藻灰中提取
的形式存在。实验室从海藻灼烧后的海藻灰中提取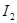 的流程如图所示:
的流程如图所示: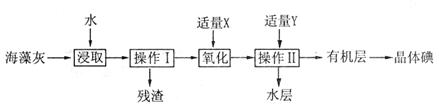
(1)操作I是__________,操作II是__________。
(2)试剂X可以选择__________。
A. 氯气 B. 氢氧化钠 C. 过氧化氢 D. 稀硫酸
(3)试剂Y可以选择__________。
A. 酒精 B. 四氯化碳 C. 醋酸 D. 苯
(4)该实验中为使海藻灰中I-转化为I2的有机溶液,除烧杯、普通漏斗和必要的夹持仪器外,还需要的玻璃仪器有__________、__________。
(5)操作II完成后,判断水层中是否残留I2的实验方法是__________。
某实验小组的同学为探究Na2O2与SO2的反应,用下图所示装置进行实验。通入SO2气体后,将带火星的木条插入试管C中,木条复燃。
请回答下列问题:
(1)A装置中浓硫酸的作用是__________。
(2)部分同学依据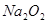 和
和 的反应,用类比的方法推理
的反应,用类比的方法推理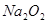 与
与 反应的固体产物为__________。另一部分同学依据
反应的固体产物为__________。另一部分同学依据 的强还原性和
的强还原性和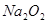 的强氧化性,猜想产物中含有
的强氧化性,猜想产物中含有 。为检验生成物中是否存在
。为检验生成物中是否存在 ,他们设计了如下实验方案:
,他们设计了如下实验方案:
请判断上述方案是否合理__________,简要说明理由:__________。
(3)向 溶液中缓慢通入
溶液中缓慢通入 气体,请分析通入
气体,请分析通入 物质的量与溶液中溶质组成的关系,填写下表空格。
物质的量与溶液中溶质组成的关系,填写下表空格。
 的范围 的范围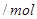 |
溶液中溶质的化学式 |
| (0,0.5) |
__________ |
| __________ |
 、 、 |
请在下图中画出溶液中溶质的总质量随缓慢通入 物质的量的变化曲线。(作图时请在起点、拐点和终点注明坐标)
物质的量的变化曲线。(作图时请在起点、拐点和终点注明坐标)
用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质(不与盐酸反应)的样品,配成500 mL待测溶液。称量时,样品可放在(填编号字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.2000 mol·L-1的盐酸来滴定待测溶液,不可选用(填编号字母)作指示剂。
A.甲基橙 B.石蕊 C.酚酞 D.甲基红
(3)滴定过程中,眼睛应注视;
在铁架台上垫一张白纸,其目的是。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是mol·L-1,烧碱样品的纯度是。
| 滴定次数 |
待测溶液体积(mL) |
标准酸体积 |
|
| 滴定前的刻度(mL) |
滴定后的刻度(mL) |
||
| 第一次 |
10.00 |
0.40 |
20.50 |
| 第二次 |
10.00 |
4.10 |
24.00 |
(5)下列实验操作对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果________。
②若将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则滴定结果________。
(每空1分,共7分)某兴趣小组用石灰石和稀盐酸反应制取CO2,并验证CO2的性质。在确认装置气密行良好后进行实验。把制得的气体通入澄清石灰水中,发现石灰水没有变浑浊。对此展开探究:
(1)[提出问题]澄清石灰水为什么水没有变浑浊?
[猜想与验证]①甲同学认为可能澄清石灰水已变质。他取少量澄清石灰水于试管中,向其中吹气,现象是:_____,说明澄清石灰水没有变质。
②乙同学认为制得的CO2中可能有HCl气体。他作出此猜想的依据是_____________________,他用试管取少量紫色石蕊试液,再通入制得的气体,紫色石蕊试液变红,他得出结论是CO2中混有气体。
③丙同学认为乙同学的实验结论是错误的,理由是_________________________,请你帮助他们设计实验证明:
[实验验证]
| 实验步骤 |
实验现象 |
实验结论 |
| CO2中混有HCl气体 |
(2)反思与评价丁同学认为既然用稀盐酸制得的CO2不纯,为何不用H2SO4代替盐酸。请问丁同学的想法对吗?________;理由是_________________________________________。