(12分)一定质量的液态化合物XY2,在标准状况下一定质量的O2中恰好完全燃烧,反应方程式为:XY2(l)+3O2(g)===XO2(g)+2YO2(g),冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56 g·L-1,则:
(1)反应前O2的体积是________。
(2)化合物XY2的摩尔质量是________。
(3)若XY2分子中X、Y两元素的质量比是3∶16,则X、Y两元素分别为________和________(写元素符号)。
电解原理在化学工业中有广泛应用。右图表示一个电解池,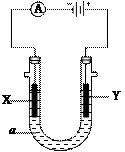
装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同
时在两边各滴入几滴酚酞试液,则
①Y电极上的电极反应式为,
检验该电极反应产物的方法是。
②电解池中X极上的电极反应式为。
在X极附近观察到的现象是。
③电解一段时间后,若收集到H2为2L,则同样条件下收集的Cl22L(填“>”“<”“=”),
原因是。
(2)如果在铁件的表面镀铜防止铁被腐蚀,电解液a选用CuSO4溶液,请回答:
①X电极对应的金属是______(写元素名称),其电极反应式。
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二
者质量差为5.12 g,则电镀时电路中通过的电子为________________mol。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因
。
肼(N2H4)又称联氨,是一种可燃性液体,用作火箭燃料。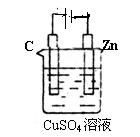
(1)32.0g该液态化合物在氧气中完全燃烧生成氮气放出热量624kJ(25°C,101kPa),则肼完全燃烧的热化学方程式 。
(2)肼——空气燃料电池是一种无污染的清洁的碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时,作负极的燃料是 (填化学式);正极的电极反应式是 。
(3)右图是一个电化学过程示意图。
①锌片上发生的电极反应是________________________。
②假设使用肼一空气燃烧电池作为本过程中的电源,锌片的质量
变化是128g,则肼一空气燃料电池理论上消耗标准状况下的空气_____L
(假设空气中氧气体积含量为20%)
X、Y、Z均为短周期非金属元素的单质。在一定条件下有如下反应:Y+X→A(气体),Y+Z→B(气体)。请针对以下两种不同情况回答:
(1)若常温下X、Y、Z均为气体,A和B化合时有白烟产生,德国化学家哈伯因为研究A的工业合成曾两度获得诺贝尔奖,则:
①有人说,哈伯解决了全世界人的吃饭问题,请你说说对这句话的理解。
②A与氧气反应生成C和D,是化工生产上的重要反应,写出该反应的化学方程式,C是大气污染物,说出一种C造成污染的现象,
③将C与A混合,在一定条件下可转化为无毒的X和D,该反应中氧化产物与还原产物的质量之比为。
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
①B的化学式是;
②向苛性钠溶液中通入过量的A,所发生反应的离子方程式是;
③将Y与(1)中Z单质的水溶液充分反应可生成两种强酸,该反应的化学方程式是。
土壤是人类从事农业、林业生产的一项重要资源。保护土壤防止污染、合理利用土壤是我们每个人的职责。请回答问题。
(1)有人说,电动自行车的发展,可能是环保背后的更大污染。这一说法的原因是
。
(2)农作物的生长对于土壤的酸碱性有一定的要求,有的喜酸性,有的喜碱性。适于一般农作物生长的PH在6.5-7.5之间,酸性或碱性过强都不利于作物的生长。土壤的碱性主要是由于土壤中的 、
、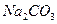 等盐类的水解而产生,请用离子方程式表示
等盐类的水解而产生,请用离子方程式表示 、
、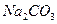 的水解 ;。指出土壤显酸性的可能原因(填出一条合理方案即可)。
的水解 ;。指出土壤显酸性的可能原因(填出一条合理方案即可)。
(3)土壤里发生着大量的氧化还原反应,许多氧化还原反应是在微生物存在的条件下进行的。如当土壤通气性良好时,土壤团粒的空隙里含有氧气,这时,在好气性微生物的作用下氧化反应得以顺利进行,土壤里的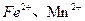 等被氧化为
等被氧化为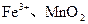 等。从能量的转化角度来说,微生物的活动所需的能量来自。从化学反应的角度来说,这些微生物在氧化还原反应过程中所起的作用是。
等。从能量的转化角度来说,微生物的活动所需的能量来自。从化学反应的角度来说,这些微生物在氧化还原反应过程中所起的作用是。
已知琥珀酸亚铁是常见治疗缺铁性贫血的补铁药剂的主要成分,该药品不溶于水但能溶于人体中的胃酸。请回答相关问题。
(1)常见治疗缺铁性贫血的补铁药剂通常都制成糖衣片,除了服用方便外它的另一个最重要的原因是。
(2)某同学为了检测某补铁药剂药片中Fe2+的存在,设计并进行了如下实验:
a、将药片去除糖衣,碾碎。
b、将碾碎的药片粉末转移到锥形瓶中,加入试剂A,过滤,得浅绿色溶液
c、向滤液中加入硫氰化钾溶液,溶液呈淡红色,加入几滴新制氯水,溶液立即出现血红色
d、向血红色溶液中继续滴加氯水,并振荡,静止几分钟,红色褪去。请回答下列问题
①操作a中碾碎药片所使用的主要仪器是
②试剂A是,
③加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是。
④用方程式表示溶液出现血红色的原因 。
⑤对溶液最后褪色的原因,甲、乙两位同学首先进行了猜想:
甲同学认为:可能是溶液中的+3价Fe又被还原为+2价Fe
乙同学认为:可能是溶液中的SCN-被过量的氯水氧化
基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确。写出有关的实验操作、预期现象和结论。