为了除去粗盐中Ca2+、Mg2+、SO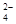 及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是
及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是
①过滤②加过量的NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液
| A.①④②⑤③ | B.④①②⑤③ | C.②⑤④①③ | D.⑤②④①③ |
已知某温度下某些弱酸的电离常数如下表:
| 弱酸 |
HCN |
HF |
CH3COOH |
HNO2 |
| Ka |
6.2×10-10 |
6.8×10-4 |
1.8×10-5 |
6.4×10-6 |
物质的量浓度都为0.1 mol·L-1的下列溶液中,pH最小的是
A.HCN B.HF C.CH3COOHD.HNO2
已知分解1mol H2O2放出热量98KJ。在含有少量I 的溶液中,H2O2分解的机理为:
的溶液中,H2O2分解的机理为:
① H2O2+ I
 H2O+IO
H2O+IO (慢)
(慢)
②H2O2+ IO
 H2O+O2+ I
H2O+O2+ I (快)
(快)
下列有关该反应的说法正确的是
A.反应速率与I 浓度有关 浓度有关 |
B.IO 也是该反应的催化剂 也是该反应的催化剂 |
| C.该化学反应速率由反应②决定 |
D. |
X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为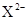 和
和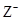 ,Y+和
,Y+和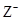 具有相同的电子层结构。下列说法正确的是
具有相同的电子层结构。下列说法正确的是
| A.原子的最外层电子数:X>Y>Z | B.单质沸点:X>Y>Z |
C.离子半径: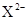 > Y+> > Y+>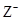 |
D.原子序数:X>Y>Z |
反应:2SO2+O2 2SO3,经过一段时间后, SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04mol/(L·S),则这段时间为
2SO3,经过一段时间后, SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04mol/(L·S),则这段时间为
| A.0.1S | B.2.5S | C.5S | D.10S |
碱性电池具有容量大、放电电流大的特点,因而得到广泛使用,锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应为:ZN(s)+2MNO2(s)+H2O(l)﹦ZN(OH)2(s)+MN2O3(s)。下列说法错误的是
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MNO2(s)+H2O(l)+2e-﹦MN2O3(s)+2OH-(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |