(1)下列每组中都有一种物质与其他物质在分类上不同,试分析每组中物质的组成规律,将这种不同于其他物质的物质找出来.
①NaCl、KCl、NaClO、BaCl2 ②浊液、溶液、胶体、水
(2)用98%的浓H2SO4(ρ=1.84 g/cm3)配制500 ml 0.5 mol/L的稀H2SO4,所需浓H2SO4的体积为________ml(小数点后保留一位有效数字),如果实验室有10 ml、20 ml、50 ml量筒,应选用 ml量筒,实验中还需要用到的仪器有 ,若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①浓硫酸溶解后未冷却至室温即转移至容量瓶进行定容________②定容时仰视刻度线
③量取好浓硫酸倒入烧杯溶解后,用水洗涤量筒2-3次,将洗涤液倒入烧杯
(3)7.8g的镁铝合金与足量的稀盐酸反应,生成氢气的体积为8.96L(标准状况),则此反应中转移电子的个数为________________,由镁和铝分别产生的氢气的体积之比为________________
(4)取100ml的Na2CO3和Na2SO4的混合溶液与过量盐酸反应,生成0.896L(标况)CO2;若向原混合溶液中加入足量的Ba(OH)2溶液,得到沉淀的质量为10.21g,试计算混合溶液中Na2CO3的物质的量浓度是___________mol/L, Na2SO4的物质的量浓度是___________mol/L。
有甲、乙两位同学根据所学化学知识,设计了由铜和硫酸为原料制取硫酸铜的两种方案:①铜与浓硫酸加热直接反应,即Cu→CuS04
②将铜加到热的稀硫酸中并通入空气来制备硫酸铜,即由Cu→CuO→CuSO4,
试回答:
(1)、写出方案①的化学反应方程式
这两种方案,你认为哪一种方案比较合理?。(答编号),理由是
(2)、实验室采用方案①取6.4 g铜片和10 mL 18 mol·L-1浓硫酸,放在试管中共热时发现,铜与热的浓硫酸反应后并没有得到预期的蓝色溶液,而是在试管底部看到灰白色沉淀。甲、乙两位同学为了验证其中灰白色沉淀的主要成分,设计下列实验:
实验步骤:倾倒掉上层液体后,向所得灰白色的固体中加入适量蒸馏水,边加边搅拌
实验现象:_____________________________________________
实验结论:所得灰白色固体的化学式为________
直到最后反应完毕,发现试管中还有铜片剩余。可两位同学仍然认为试管中还有硫酸剩余,他们这样认为的理由是________________
为探索乙醇氧化的反应机理,某研究性学习小组的学生设计了下列实验方案。
(1) 将一根粗铜丝绕成螺旋状,称量得到数值m1 g ;
(2) 取一支试管,加入3 mL 乙醇;
(3) 把上述已称量过的铜丝放在酒精灯火焰上加热至红热后稍冷,可看到铜丝___________
_______________________________(填写现象),称量得到数值 m2 g,并且m2_____ m1 (填“大于”、“小于”或“等于”)
(4) 将冷却后的铜丝伸入试管里的酒精溶液中,可看到铜丝________________________(填写现象)
(5) 若将红热的铜丝伸入试管里的酒精溶液中,可看到铜丝________________________(填写现象)
(6) 反复多次后,可闻到试管里溶液有____________________________________________;
(7) 最后将从酒精溶液中取出的铜丝烘干后称量,得到数值 m3 ,则m3_____________ m1(填“大于”、“小于”或“等于”)
(8) 步骤(3)中的化学反应方程式为_____________________________,步骤(5)中的化学方程式为_____________________,总的反应方程式为___________________________。
实验室制乙烯时因使用的试剂浓硫酸既有强脱水性,又有强氧化性,在加热条件下,乙醇很有可能与浓硫酸参加反应,生成二氧化碳、二氧化硫、水蒸气、炭。该副反应的化学方程式是:_________________________________有同学设计了如下三个方案检验,检验二氧化碳、二氧化硫、水蒸气这三种物质的存在,请评价是否可行?
方案一:
方案二:
方案三:
你认为合理的设计方案应怎样?
某同学用下图所示装置制取乙烯,请回答: 
(1)在装置①~③中,有明显错误的一个装置是_____(填序号)。
(2)实验室制取乙烯的化学方程式为。
(3)若装置②中所盛试剂为氢氧化钠溶液,则其作用为。
(4)若装置③中的试剂为溴的四氯化碳溶液,则所发生的反应类型为________反应。
(5)实验前往往在烧瓶中加入一些碎瓷片,目的是:__________________________。
实验室用固体NaOH配制0.5 mol/L的NaOH溶液500 mL,有以下仪器和用品有:①烧杯 ②100 mL量筒 ③容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码)
(1)配制时,没有使用的仪器和用品有____________(填序号),还缺少的仪器是。
(2)在配制的转移过程中某学生进行如右图操作,请指出其中的错误:、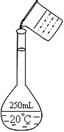
(3)下列操作会使配制的溶液浓度偏低的是(填字母)
A. 没有将洗涤液转移到容量瓶B.转移过程中有少量溶液溅出
C. 容量瓶洗净后未干燥 D.定容时俯视刻度线
(4)在容量瓶使用方法中,下列操作不正确的是(填序号)
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用碱液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
(5) 实验中还需要2mol/L的NaOH溶液950mL,配制时应选用的容量瓶的规格和称取NaOH的质量分别是(填序号)
A.1000mL,80gB.950mL,76g
C.任意规格,72gD.500mL,42g