PCl3可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
| |
熔点/℃ |
沸点/℃ |
密度/g·mL-1 |
其他 |
| 黄磷 |
44.1 |
280.5 |
1.82 |
2P(过量)+3Cl2 2PCl3;2P+5Cl2(过量) 2PCl3;2P+5Cl2(过量) 2PCl5 2PCl5 |
| PCl3 |
—112 |
75.5 |
1.574 |
遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 |
2 |
105.3 |
1.675 |
遇水生成H3PO4和HCl,能溶于PCl3 |
(一)制备:下图是实验室制备PCl3的装置(部分仪器已省略)
(1)仪器乙的名称 。
(2)实验室以制备Cl2的离子方程式: 。
(3)碱石灰的作用是 , 。
(4)向仪器甲中通入干燥Cl2之前,应先通入一段时间的CO2,其目的是 。
(二)提纯:
(5)粗产品品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,通过 (填实验操作名称),即可得到PCl3的纯品。
(三)分析:
测定产品中PCl3纯度的方法如下:迅速称取m g产品,水解完全后配成500mL溶液,取出25.00mL加入过量的c1 mol/L V1 mL 碘溶液,充分反应后再用c2 mol/L Na2S2O3溶液滴定过量的碘,终点时消耗V2 mL Na2S2O3溶液。
已知:H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6;假设测定过程中没有其他反应。
(6)根据上述数据,该产品中PCl3的质量分数为 (用含字母的代数式表示、不必化简)。
某研究性学生小组查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO42CaSO4+2Cl2↑+2H2O他们设计了如图所示装置制取氯气并验证其性质的实验。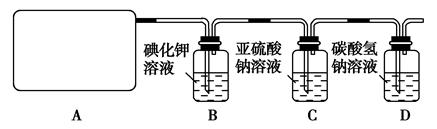
试回答:
(1)该实验中A部分的装置是________(填写装置的序号);
(2)B中反应的化学方程式是。
(3)写出C中反应的离子方程式,并请你帮该小组同学设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤):_________________。
(4)写出在D装置中发生反应的离子方程式。
(5)该实验存在明显的缺陷是__________________________________。
(6)该小组又进行了如下实验:称取漂白粉2.0 g,研磨后溶解,配制成250 mL溶液,加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1 mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为2Na2S2O3+I2===Na2S4O6+2NaI,反应完成时,共消耗Na2S2O3 200 mL。则该漂白粉中Ca(ClO)2的质量分数为________。
(10分)某活动课程小组拟用50 mL NaOH溶液吸收CO2气体,制备Na2CO3溶液.为了防止通入过量的CO2气体生成NaHCO3,设计了如下实验步骤:
a.取25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
b.小火煮沸溶液1~2 min,赶走溶解在溶液中的CO2气体;
c.在得到的溶液中加入另一半(25 mL)NaOH溶液,使其充分混合反应.
(1)此方案能制得较纯净的Na2CO3,写出c步骤的离子方程式_________________.
此方案第一步的实验装置如下图所示:
(2)加入反应物前,如何检验整个装置的气密性:________________________________________________________________________
(3)若用大理石与盐酸制CO2,则装置B中盛放的试剂是______,作用是_____________________________________________
(4)在实验室通常制法中,装置A还可作为下列______(填序号)气体的发生装置.
①HCl ②H2 ③O2 ④NH3
(5)已知所用NaOH溶液中溶质的质量分数为40%,室温下该溶液密度为1.44 g/mL,假设反应前后溶液的体积不变,不考虑实验误差,计算用此种方法制备所得Na2CO3溶液的物质的量浓度为_______mol/L.
测定SO2转化成SO3的转化率可以用下图装置,装置中烧瓶内发生的化学反应方程式为:Na2SO3(s)+H2SO4(85%)=Na2SO4+H2O+SO2↑。
(已知SO3的熔点是16.8℃,沸点是44.8℃)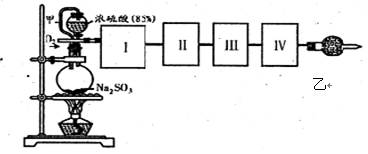
(1)装置中甲管的作用是;
乙装置的作用是。
(2)根据实验需要,应该在I、II、Ⅲ、IV处连接合适的装置,请从下图A~E装置中选择最适合装置并将其序号填放下面的空格中。I、Ⅱ、Ⅲ、Ⅳ处连接的装置分别是、、、。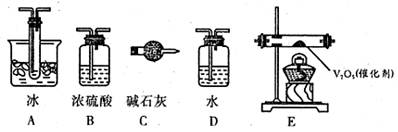
(3)为使SO2有较高的转化率,实验中加热 催化剂与滴加浓硫酸的顺序中,应采取的操作
催化剂与滴加浓硫酸的顺序中,应采取的操作 是,若用大火加热烧瓶时,SO2的转化率会(填“升高”、“不
是,若用大火加热烧瓶时,SO2的转化率会(填“升高”、“不 变”或“降低”)。
变”或“降低”)。
(4)将SO2通入含1 mol氯酸的溶液中,可生成一种强酸和一种氧化物,并有6.02×1023个电子转移,则该反应的化学方程式为。
(5)用nmolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅳ增重了mg,则实验中SO2的转化率为。(用含m、n的代数式填写)
从固体混合物A出发可以发生如下框图所示的一系列变化。
(1)在实验室,气体C的检验方法是。
(2)操作②的名称是,该操作所使用的玻璃仪器有。
(3)写出下列反应的离子方程式:
反应③;
反应④。
实验中多余的气体I必须吸收,以免污染空气。下图是实验室用NaOH吸收气体I的装置,为防止产生倒吸现象,不合理的装置是(填序号)。
某同学设计了以下流程来检验碳酸钠粉末中可能含有少量氯化钠和氢氧化钠中的一种或两种杂质。
(1)步骤1所需玻璃仪器是;步骤3的操作名称是
(2)对检验碳酸钠粉末中可能含有的杂质提出合理假设:
假设1: 只含有氯化钠
假设2: 只含有
假设3: 氯化钠和氢氧化钠都含有
(3)设计实验方案,对假设3进行检验。
限选以 下试剂:氯化钡溶液、硝酸钡溶液、酚酞试液、稀硝酸、稀盐酸、稀硫酸、硝酸银溶液。回答下列问题:
下试剂:氯化钡溶液、硝酸钡溶液、酚酞试液、稀硝酸、稀盐酸、稀硫酸、硝酸银溶液。回答下列问题:
②入过量试剂A的名称是_______________________。
②填写下表:
| 实验步骤 |
预期现象和结论 |
| 步骤4: |
|
| 步骤5: |