课题式研究性学习是培养学生创造思维的良好方法.某研究性学习小组将下列装置如图连接,D、F、X、Y 都是铂电极、C、E是铁电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
(1)电源B 极的名称是___________。
(2)甲装置中电解反应的总化学方程式是:___________ _____。
(3)设电解质溶液过量,则同一时内C、D电极上参加反应的单质或生成的单质的物质的量之比是__________。
(4)欲用丙装置将粗铜(含少量铁、锌等杂质)精炼,G极材料应该是__________(填“粗铜”或“精铜”),电解液中原电解质的物质的量浓度将__________(填“变大”、“变小”或“不变”)。
(5)装置丁中的现象是________________________________________。
(6)设甲池中溶液的体积在电解前后都是500ml,当乙池所产生气体的体积为4.48L(标准状况)时,甲池中所生成物质的物质的量浓度为 mol/L。
物质结构的多样性让人类使用的材料精彩纷呈。
(1)如图是原子序数相连的七种短周期元素第一电离能示意图。其中硼B元素是(填图中元素代号)。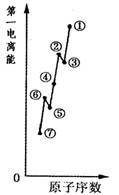
(2)乙二酸俗名草酸,是最简单的有机二元酸之一,结构简式为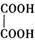 ,草酸钠晶体中存在(填图中元素代号)。
,草酸钠晶体中存在(填图中元素代号)。
A金属键;B非极性键;C键;D范德华力;E氢键;F离子键
(3)氧化锆(ZrO2)材料具有高硬度,高强度,高韧性,极高的耐磨性及耐化学腐蚀性,氧化锆陶瓷在许多领域获得广泛应用。锆石与钛同族的第五周期元素,锆原子的价电子排布式为。
(4)含氧酸可电离的氢原子来自羟基,碳酸的结构式可表达为;若碳酸中的碳氧原子都在同一平面,则碳原子的杂化类型是。
(5)PtCl4和氨水反应可获得PtCl4• 4NH3,PtCl4•4NH3 是一种配合物。100mL0.1mol•L-1PtCl4•4NH3 溶液中滴加足量AgNO3溶液可产生2.87g白色沉淀。该配合物溶于水的电离方程式为。
(NH4)2Fe(SO4)2·6H2O俗名摩尔盐,价格便宜,可用来净水或治疗缺铁性贫血等,是一种重要的化工原料。
(1)摩尔盐的水溶液呈色。
(2)c(Fe2+)相同的摩尔盐和硫酸亚铁两溶液比较,物质的量浓度较大的是。
(3)甲乙两位同学想测定一瓶摩尔盐的纯度。甲同学设计的实验装置如图1: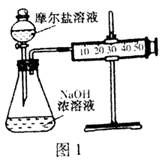
从上图推断甲同学想通过测定计算摩尔盐的纯度。该方案的不足之处在于。
(4)乙同学在甲同学的基础上做了改进,其实验装置如图2: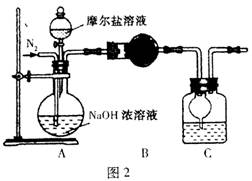
则B与C中的试剂分别是和。C中干燥管的作用是。乙同学称取了10.0g的摩尔盐样品,若实验完毕后测得洗气瓶及瓶内溶液共增重O.68 g,则依此数据推算这份摩尔盐的纯度为%(答案精确到小数点后第一位)。
高铁酸钾(K2FeO4)有强氧化性,是一种安全性很高的水处理剂。
(1)高铁酸钾中铁元素的化合价是,它可以将废水中的亚硝酸钾(KNO2)氧化,同时生成具有吸附性的Fe(OH)3,该反应的化学方程式为。
(2)某学习小组用废铁泥(主要成分为Fe3O3、FeO、CuO和少量Fe)制备高铁酸钾的流程如下:
①操作Ⅰ要在通风橱中进行,其原因是。
②溶液A中含有的金属阳离子是。
③25℃时,若将溶液B中的金属离子完全沉淀,应调节c(H+)小于。(已知:i. Ksp[Fe(OH)3]=2.7×10-39、Ksp[Fe(OH)2] =4.0×10-17、Ksp[Cu(OH)2] =1.6×10-20;ii. 溶液中离子浓度小于10-5 mol·L-1时,可视为沉淀完全。)
④该小组经多次实验,得到如图结果,他们的实验目的是。
(3)高铁酸钾还可以用电解法制取,电解池以铁丝网为阳极,电解液使用氢氧化钾溶液,其阳极反应式为。
X、Y、Z三种短周期元素,其中X元素的原子序数大于Y,且X、Y的氧化物都是形成酸雨的主要物质。Z是地壳中含量最高的金属元素;而地壳中含量最高的非金属元素与X同主族、与Y同周期。
(1)实验室用H2XO4制取XO2气体的化学反应方程式为。(请用具体元素符号表示化学式,下同)
(2)t℃时,0.1 mol·L-1的NaHXO3溶液pH=6,该溶液中各离子浓度由大到小顺序排列为。
(3)请写出Z的氧化物与烧碱溶液反应的离子方程式。
(4)一定条件下,YO与YO2存在下列反应:YO(g)+ YO2(g)  Y2O3(g),其平衡常数表达式为K=。
Y2O3(g),其平衡常数表达式为K=。
(5)工业上用氧化YH3法制取YO,该反应的热化学方程式为:
4YH3(g)+5O2(g)=4YO(g)+6H2O(g) △H=-905.8kJ·mol-1;
已知Y2(g)+O2(g)=2YO(g)△H="+180" kJ·mol-1,则YH3与氧气反应产生两种无污染物质的热化学式为。
有机物H是一种合成药物的中间体,H的合成方案如下: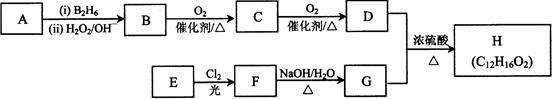
已知:R-CH=CH2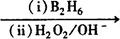 R-CH2-CH2OH
R-CH2-CH2OH
请回答下列问题:
(1)A是相对分子质量为104的芳香烃,A的分子式为。
(2)鉴别A和C两种有机物试剂为。
(3)F为一氯代物,其核磁共振氢谱有三个吸收峰,则E的结构简式为。
(4)写出B→C的化学方程式:。
(5)写出D和G生成H的化学方程式:。
(6)D的同分异构体中能与FeCl3溶液发生显色反应且能发生银镜反应的有种,写出其中核碰共振氢谱中吸收峰数目最少的结构简式:_____________。