高铁酸钾(K2FeO4)有强氧化性,是一种安全性很高的水处理剂。
(1)高铁酸钾中铁元素的化合价是 ,它可以将废水中的亚硝酸钾(KNO2)氧化,同时生成具有吸附性的Fe(OH)3,该反应的化学方程式为 。
(2)某学习小组用废铁泥(主要成分为Fe3O3、FeO、CuO和少量Fe)制备高铁酸钾的流程如下:
①操作Ⅰ要在通风橱中进行,其原因是 。
②溶液A中含有的金属阳离子是 。
③25℃时,若将溶液B中的金属离子完全沉淀,应调节c(H+)小于 。(已知:i. Ksp[Fe(OH)3]=2.7×10-39、Ksp[Fe(OH)2] =4.0×10-17、Ksp[Cu(OH)2] =1.6×10-20;ii. 溶液中离子浓度小于10-5 mol·L-1时,可视为沉淀完全。)
④该小组经多次实验,得到如图结果,他们的实验目的是 。
(3)高铁酸钾还可以用电解法制取,电解池以铁丝网为阳极,电解液使用氢氧化钾溶液,其阳极反应式为 。
自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:SiO2(s) +4HF(g) SiF4(g)+ 2H2O(g)+148.9 kJ
SiF4(g)+ 2H2O(g)+148.9 kJ
根据题意完成下列填空:
(1)在地壳深处容易有 气体逸出,在地壳浅处容易有 沉积。
(2)如果上述反应的平衡常数K值变大,该反应 (选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时, (选填编号)。
a.2v正(HF)=v逆(H2O)b.v(H2O)=2v(SiF4)
c.SiO2的质量保持不变d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为 。
雄黄(AS4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为 。
(2)上述反应中的氧化剂是 ,反应产生的气体可用 吸收。
(3) As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3—=2H3AsO4+ 3S+10NO2↑+ 2H2O
若生成2mol H3AsO4,则反应中转移电子的物质的量为 。若将该反应设计成一原电池,则NO2应该在 (填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量 (选填编号)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5mold.无法确定
铝是国民经济发展的重要材料,铝在地壳中的含量约占8%,目前我国铝消费量超过430万吨,在众多的金属中仅次于铁。请回答下问题:
(I )实验室中用金属铝制备少量氢氧化铝,有以下3种方案:
方案1:
方案3 :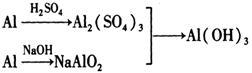
制备相同物质的量的氢氧化铝消耗酸和碱最少的是方案_____________________。
(II)工业上冶炼铝的流程图如图所示: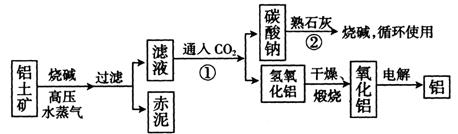
在制取氧化铝的过程中,分析铝土矿和赤泥中所含Al2O3、Fe203质量分数的数据如下:
| Al2O3 |
Fe2O3 |
其他杂质 |
|
| 铝土矿 |
55% |
16% |
— |
| 赤泥 |
15% |
48% |
一 |
(1) 书写化学方程式,反应①_______,
反应②________________
(2) 电解氧化铝生产铝时,阳极的电极反应式为_____________。
(3) 假设其它杂质不参加反应,则每生产3.4t纯净的氧化铝,需铝土矿________t
有机物A(C11H12O2)可调配果味香精。可用含碳、氢、氧三种元素的有机物B和C为原料合成A。
(1)B的蒸汽密度是同温同压下氢气密度的23倍,分子中碳、氢原子个数比为1:3。有机物B的分子式为。
(2)有机物C的分子式为C7H8O,C能与钠反应,不与氢氧化钠溶液反应,也不能使溴的四氯化碳溶液褪色。C的结构简式为 ,C与苯酚是否互为同系物: (填“是”或“否”)
(3)已知两个醛分子间能发生如下反应: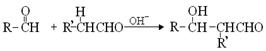 (﹣R、﹣R’表示氢原子或烃基)
(﹣R、﹣R’表示氢原子或烃基)
用B和C为原料按如下路线合成A: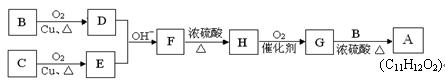
① 上述合成过程中涉及到的反应类型有:(填写序号)
a取代反应;b 加成反应;c 消去反应;d 氧化反应;
② 写出D与银氨溶液反应的化学方程式:。
③ F的结构简式为: 。
④ 写出G和B反应生成A的化学方程式:
。
(4)F的同分异构体有多种,写出既能发生银镜反应又能发生水解反应,且苯环上只有一个取代基的所有同分异构体的结构简式。
有V、W、X、Y、Z五种元素,它们是核电荷数依次增大的前四周期元素;X、Z是金属元素;V和X元素原子的最外层电子都只有一个;W和Y元素原子的最外层电子数相同,且W元素原子L层电子数是K层电子数的3倍;Z是一种常见金属元素,可以形成3种氧化物,其中一种氧化物是具有磁性的黑色晶体。由此可知:
(1)X在元素周期表中的位置是,Z的元素符号是
(2)V-W和V—Y属于极性共价键,其中极性较强的键是______(V、W、Y用元素符号表示)。
(3)w与X形成原子个数之比为1:1的化合物的电子式为
(4)工业上冶炼Z单质的化学方程式为