以丁二烯为原料来制取某缩聚物G。
请完成下列各题:
(1)写出反应类型:反应① 反应④
(2)写出反应条件:反应③ 反应⑥
(3)反应②③的目的是: 。
(4)写出反应⑤的化学方程式: 。
(5)B被氧化成C的过程中会有中间产物生成,该中间产物可能是 (写出一种物质的结构简式),检验该物质存在的试剂是 。
(6)写出G的结构简式 。
(8分)A、B、C、D为四种可溶性的盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是NO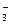 、SO
、SO 、Cl-、CO
、Cl-、CO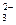 的中的一种。
的中的一种。
①若把四种盐分别溶解于盛有蒸气水的四支试管中,只有C盐的溶液呈蓝色。
②若向①的四支试管中分别加入盐酸,B盐的溶液有沉淀生成,D盐的溶液有无色无味的气体逸出。
根据①②实验事实可推断它们的化学式为:
(1)A,C
(2)写出盐酸与D反应的离子反应方程式:
(3)写出C与Ba(OH)2溶液反应的离子方程式
(8分)如图所示,在一条鱼、虾几乎绝迹的河边,从上游到下游依次有甲、乙、丙、丁四座工厂,各厂排放的废水里都只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种。某中学环保小组对河水检测时发现:①甲处河水呈乳白色;②乙处河水呈红褐色;③丙处河水由浑变清;④丁处产生气泡,河水仍澄清。请回答:
(1)四座工厂排出的废水里含有的污染物分别为:
甲:乙:丙:丁:(填化学式)
(2)在丁的下游M处取出的河水中,肯定含有的离子是。
(3)写出有关反应的离子方程式:
。
右图是硫酸试剂瓶标签上的内容:
(1)该硫酸的物质的量浓度是mol/L。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要240 mL 4.6 mol/L的稀H2SO4,则需要取mL的该硫酸,将上述硫酸进行稀释的实验操作为。
(3)在配制4.6 mol/L稀H2SO4的过程中,下列情况对硫酸溶液物质的量浓度有何影响(填“偏高”、“偏低”或“无影响”)。①未经冷却趁热溶液注入容量瓶中:。
②容量瓶用1mol/L稀H2SO4润洗:。③定容时仰视观察液面。
(4)常温下,某学生取出少量试剂瓶中的硫酸于一洁净试管中,加入几片铝,结果铝片表面没有气泡产生,也未发现铝片溶解,试帮助该同学分析其原因。
有下列词语:①渗析②盐析③聚沉④溶胶⑤凝胶⑥布朗运动⑦电泳
⑧丁达尔效应⑨中和⑩水解,选出适当的词语将其序号填入下列空格中。
(1)往浓肥皂中加入饱和食盐水(或固体食盐),肥皂凝聚,这种现象称为 。
。
(2)在肥皂水中透过强光,可看到光带,这种现象称为。
(3)使热的浓肥皂水冷却并完全固化后的物质叫。
(4)在肥皂水中加入酚酞变红色,说明高级脂肪酸根离子发生了。
(5)在Fe(OH)3胶体中加入(NH4)2SO4产生红褐色沉淀,这种现象叫做。
(6)用半透膜把制取Fe(OH)3胶体中生成的氯化钠分离出的方法叫做。
(7)在水泥和冶金工厂常用高压电对气溶胶作用,除去大量烟尘,以减少对空气的污染。这种做法应用的主要原理是。
储氢纳米碳管研究成功体现了科技的进步。但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯。其反应,式为:
C + K2Cr2O7 + H2SO4→ CO2 + Cr2(SO4)3+ K2SO4 + H2O
(1)完成并配平上述反应的化学方程式并标出电子转移方向与数目;
(2)此反应的氧化剂是,氧化产物是;
(3)H2SO4在上述反应中表现出来的性质是(填选项编号)
| A.酸性 | B.氧化性 | C.吸水性 | D.脱水性 |
(4)上述反应中若产生0.1mol CO2气体,则转移电子的 物质的量是mol。
物质的量是mol。