(14分)在200℃时,将a mol H2(g)和b mol I2(g)充入到体积为V L的密闭容器中,发生反应:I2(g)+H2(g)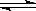 2HI(g)。
2HI(g)。
(1)反应刚开始时,由于c(H2)=_______,c(I2)=_______,而c(HI)=________,所以化学反应速率________最大而________最小(为零)(填“v正”或“v逆”)。
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)________,c(I2)________,而c(HI)________,从而化学反应速率v正________,而v逆________(填“增大”、“减小”或“不变”) (3)当反应进行到v正与v逆________时,此可逆反应就达到了最大限度,若保持外界条件不变时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将________。
X、Y、Z、W是元素周期表前四周期中常见的元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
X原子基态时最外层电子数是其内层电子数的2倍 |
| Y |
Y原子基态时2p原子轨道上有3个未成对的电子 |
| Z |
Z的基态原子最外层电子排布式为:nsnnpn+2 |
| W |
W的原子序数为29 |
(1)基态W原子的价电子排布式是_________________。
(2)X、Y、Z三种元素第一电离能从大到小的顺序是____________。(填化学式)
(3)Y的氢化物分子的空间构型是_______________;该氢化物分子中Y原子轨道的杂化类型是___________。
(4)X的气态氢化物和Y的气态氢化物中沸点高的是,(填化学式)其主要原因是。
(5)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为 ,每个Ba2+与 个O2-配位。
玻璃钢可由酚醛树脂和玻璃纤维制成。
(1)酚醛树脂由酚醛和甲醛缩聚而成,反应有大量热放出,为防止温度过高,应向有苯酚的反应釜 加入甲醛,且反应釜应装有 装置。
(2)玻璃纤维由玻璃拉丝得到。普通玻璃是由石英砂、 和石灰石(或长石)高温熔融而成,主要反应的化学方程式为 。
(3)玻璃钢中玻璃纤维的作用是 。玻璃钢具有 等优异性能(写出两点即可)
(4)下列处理废旧热固性酚醛塑料的做法合理的是 。
a.深埋 b.粉碎后用作树脂填料
c.用作燃料 d.用有机溶剂将其溶解,回收树脂
在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=。
(2)该反应为反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是
(a)容器中压强不变(b)混合气体中 c(CO)不变
(c)v正(H2)=v逆(H2O)(d)c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为℃。
X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
⑴ L的元素符号为________ ;M在元素周期表中的位置为________________;五种元素的原子半径从大到小的顺序是____________________(用元素符号表示)。
⑵ Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为___,B的结构式为____________。
⑶硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为_______。该族2~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是__________(填字母代号)
a.+99.7 mol·L-1b.+29.7 mol·L-1 c.-20.6 mol·L-1d.-241.8 kJ·mol-1
⑷用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q 。写出阳极生成R的电极反应式:______________;由R生成Q的化学方程式:_______________________________________________。
食品和药物安全是党和国家高度重视的民生问题。请你根据题意,用下列选项的字母代号填空。
| A.阿司匹林(乙酰水杨酸) | B.青霉素 |
| C.抗酸药(氢氧化铝) | D.麻黄碱 |
(1)可治疗支气管哮喘,但不宜过多服用的药物是。
(2)治疗胃酸过多,但患有严重的胃溃疡,应该选择。
(3)是一种重要的抗生素类药,有阻止多种细菌生长的功能,该药物是。
(4)能使发热的病人体温降至正常,并起到缓解疼痛的作用,该药物是。