(8分)A、B、C是大家熟悉的与生命运动密切相关的三种化合物,它们所含元素不超过三种;并有如下图所示的转化关系。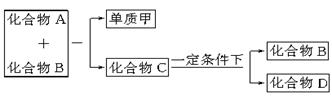
其中D是日常生活中常见的有机化合物,在一定条件下,可与单质甲进一步发生如下变化:D+3甲→3A+2B。试回答以下问题:
(1)在A、B、C、D四种化合物中,所含元素种类完全相同的是__________(写字母代码和物质名称)。
(2)在常温下,A和B通过__________作用转化为C。
(3)目前,化合物B在自然界中的含量呈上升趋势,对于环境产生了不良影响,发生这种变化的主要原因是______________________________。
24.5gH2SO4的物质的量是,1.5molNa2CO3的质量是。
解释钠投入滴有酚酞试液的水中,产生下列现象的原因:
(1)钠浮在水面
(2)钠熔化成闪亮的小球
(3) 钠小球在水面四处游动,并发出“嘶嘶”声
钠小球在水面四处游动,并发出“嘶嘶”声
(4)滴有酚酞试液的水变红
在高温时,水蒸气与灼热的炭发生氧化还原反应的化学方程式是H2O+C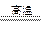 H2+CO,其中水是剂。硫在氧气中燃烧的化学方程式是,其中硫是剂。
H2+CO,其中水是剂。硫在氧气中燃烧的化学方程式是,其中硫是剂。
在某有机物A,其结构简式如图。请写出以下化学反应的方程式。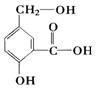
①A跟NaOH溶液反应:。
②A跟NaHCO3溶液反应:。
③A在一定条件下跟Na反应:。
(10分)已知:2CH2=CH2+O2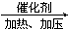 2CH3CHO,以乙烯、空气、水为原料在一定条件下能实现如下图所示的转化。
2CH3CHO,以乙烯、空气、水为原料在一定条件下能实现如下图所示的转化。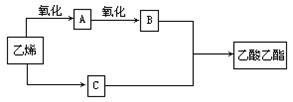
(1)物质C俗称_________,其结构简式为____________ ;
(2)写出由A→B的化学方程式____________________________;
(3)写出由B+C→乙酸乙酯的化学方程式____________________该反应是___________反应。