下图是实验室制取SO2并验证SO2某些性质的装置图。试回答:
⑴①中发生反应的化学方程式为 。
⑵②中的实验现象为 ,此实验说明SO2是 氧化物。
⑶③的品红溶液 ,证明SO2有 。
⑷④中的实验现象为 ,此实验说明SO2有 性。
⑸⑤中的实验现象为 ,此实验说明SO2有 性。
⑹⑥的作用是 ,反应方程式是 。
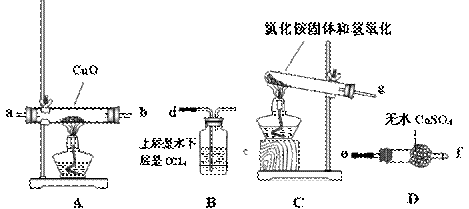
某校化学研究性学习小组的同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否象H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与活动并完成下列研究:
(1)制取氨气
①实验室制备氨气,下列方法中适宜选用的是 (填编号);
a.氯化铵溶液与氢氧化钠溶液共热;b.固体氢氧化钠中滴加浓氨水;c.固态氯化铵加热分解;d.固态硝酸铵加热分解;f.固态氯化铵与熟石灰混合加热。
②写出实验室制取氨气的化学方程式 。
(2)实验探究
该小组成员设计实验探究氨气的还原性及其产物,提供实验装置如下:
|
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容,请选择其中—题,并在相应的答题区域作答。若两题都做,则按A题评分。
A.镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)请参考下述数据填空和回答问题:
工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝。不用电解MgO的方法生产镁的原因;不用电解AlCl3的方法生产铝的原因。
(2)2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录。该化合晶体结构中的晶胞如图所示。镁原子间形成正六棱柱,六个硼原子位于棱柱内。则该化合物的化学式可表示为。
(3)写出Cu+的核外电子排布式。
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是。
(5)某喹喏酮类药物(中心离子是Cu2+)结构如下图,关于该药物的说法正确的是。
A.中心离子Cu2+的配位数是5
B.N原子均采用sp2杂化
C.存在配位键、极性共价键和非极性共价键
D.熔点很高,硬度很大
B.某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
步骤I:称取0.4 g花生油样品,置于两个干燥的碘瓶(如图)内,加入10 mL四氯化碳,轻轻摇动使油全部溶解。向碘瓶中加入25.00 mL含0.01 mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失。
步骤II:在暗处放置30 min,并不时轻轻摇动。30 min后,小心地打开玻璃塞,用新配制的10%
碘化钾10 mL和蒸馏水50 mL把玻璃塞和瓶颈上的液体冲洗入瓶内。
步骤Ⅲ:加入指示剂,用0.1 mol·L-1硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点。
测定过程中发生的相关反应如下:
①
②IBr+KI=I2+KBr
③I2+2S2O32-=2I-+S4O62-
请回答下列问题:
(1)已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应选用的仪器是,碘瓶不干燥会发生反应的化学方程式。
(2)步骤Ⅱ中碘瓶在暗处放置30 min,并不时轻轻摇动的原因是。
(3)步骤Ⅲ中所加指示剂为,滴定终点的现象。
(4)反应结束后从液体混合物中回收四氯化碳,所需操作有。
在一容积为2 L的密闭容器中加入2 molA和3 molB,保持温度为30℃,在催化剂存在的条件下进行下列反应:  ,达到平衡后生成1.2 mol C,此时,平衡混合气中C的体积分数为ω;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol。
,达到平衡后生成1.2 mol C,此时,平衡混合气中C的体积分数为ω;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol。
请回答下列问题,
(1)该反应的平衡常数K随温度升高而(填“增大”、“减少”或“不变”),该反应的焓变△H0(填“>”、“<”或“=”)。
(2)30℃时,平衡混合气中C的体积分数ω=,A物质的转化率与B物质的转化率之比为。
(3)30℃时,若在同一容器中加入3 molA、4 molB和molC,则平衡混合气中C的体积分数仍为ω,此时平衡时体系中A的物质的量浓度为mol·L-1。
某药物中间体合成路线如下(部分反应条件和产物略)
(1)写出下列物质的结构简式:A,D。
(2)反应①、②的目的是。
(3)写出满足下列条件的A的一种同分异构体的结构简式。
a.不溶于水 b.能发生银镜反应 c.含有一C(CH3)3
(4)写出B→C反应的化学方程式为。
(5) 是B的一种重要的同分异构体。请设计合理方案,完成从
是B的一种重要的同分异构体。请设计合理方案,完成从 到
到 的合成路线(用流程图表示,并注明反应条件)。
的合成路线(用流程图表示,并注明反应条件)。
提示:①合成过程中无机试剂任选:
②合成路线流程图示例如下:
双氧水(过氧化氯)被称作“最清洁”的化学品,在纺织业和造纸业主要用作漂白剂,在化工合成中用作氧化剂和环氧化剂,在食品和医药工业中用作消毒剂、杀菌剂。目前,世界上过氧化氢的生产方法主要有电解法、葸醌法等。
I、电解法中成本最低的是过硫酸铵法
电解所用电槽以铂为阳极,以铅或石墨为阴极;NH4HSO4水溶液经阴极室,再作为阳极液从阳极室流出,得(NH4)2S2O8溶液,电解总反应式: 溶液送往水解器中减压水解、蒸发,蒸出过氧化氢的水溶液,剩余溶液流到阴极室再循环使用。
溶液送往水解器中减压水解、蒸发,蒸出过氧化氢的水溶液,剩余溶液流到阴极室再循环使用。
(1)写出过氧化氢的电子式。
(2)写出水解器中(NH4)2S2O8溶液的水解方程式。
(3)铂价格昂贵,试分析电槽阳极用铂不用铅的原因。
(4)试分析水解器中使用减压水解、蒸发的原因。
Ⅱ、葸醌法是国内外大规模生产过氧化氢普遍采用的方法,生产简易流程图如下所示:
其中,触媒为催化剂,工作液为乙基葸醌与有机溶剂的混合液,主要反应方程式为:
(1)写出流程图中加“?”的操作。
(2)写出流程图中再生使用物质的名称。
(3)根据双氧水生产的特点,工业液中有机溶剂的选择很重要。理想的有机溶剂应满足以下要求:①对乙基葸醌和氢乙基葸醌具有良好的溶解能力:②粘度低,沸点高,难挥发,着火点高;③低毒性。请分析再写出两点要求:④;⑤。