A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y
的单质是生活中常见的金属,相关物质间的关系如下图所示。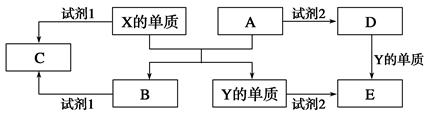
(1)X的单质与A反应的化学方程式是______________________________________。
(2)若试剂1是NaOH溶液,X的单质与试剂1反应的离子方程式是____________________________。
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是________________________________________
②将物质C溶于水,其溶液呈酸性,原因是(用离子方程式表示)_______________________________。
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是_________________________________。
下表所示的是第二周期元素中,除Be、B、Ne三种元素外,其它元素的简单氢化物的沸点;题26图所示是第三周期元素中,除Ar以外的其它元素的单质的熔点变化关系。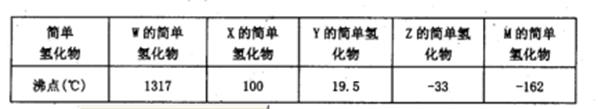
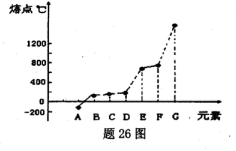
(1)X的简单氢化物属于分子(填“极性”或“非极性”),G元素的单质在固态时的晶体类型为____。
(2)写出W的氢化物的电子式______。
(3)A和Z两元素形成的一种化合物分子中各原子最外均达到8电子稳定结构,则该分子的结构式为。
(4)化合物AY能与水反应生成两种弱酸,其化学方程式为
(5)写出元素F的单质与三氧化二铬反应的化学方程式___
【化学—选修5:有机化学基础】(15分)
卤代烃在醚类溶剂中与Mg反应可制得格氏试剂,格氏试剂在有机合成方面用途广泛。设R为烃基,已知: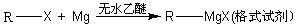

某有机物A有如下转化关系: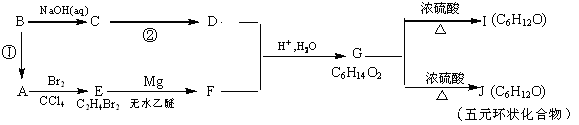
试回答下列问题:
(1)反应①的反应试剂和实验条件是
(2)C→D的化学反应方程式为;反应类型是;
(3) G的结构简式是___,G的最简单的同系物的名称是
(4)I中所含官能团的名称是
(5)分子式与I、J相同,但能发生银镜反应的异构体有种。写出其中含—CH3个数最多的异构体的结构简式
【化学-物质结构与性质】
原子序数依次递增的甲、乙、丙、丁、戊是周期表中前30号元素,其中甲、乙、丙三元素的基态原子2p能级都有单电子,单电子个数分别是2、3、2;丁与戊原子序数相差18,戊元素是周期表中ds区的第一种元素。回答下列问题:
(1)甲能形成多种常见单质,在熔点较低的单质中,每个分子周围紧邻的分子数为;在熔点很高的两种常见单质中,X的杂化方式分别为、。
(2)14g乙的单质分子中π键的个数为___________。
(3)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第
二电离能I2,依次还有I3、I4、I5…,推测丁元素的电离能突增应出现在第电离能。
(4)戊的基态原子有种形状不同的原子轨道;
(5)丙和丁形成的一种离子化合物的晶胞结构如图,该晶体中阳离子的配位数为。距一个阴离子周围最近的所有阳离子为顶点构成的几何体为。已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a=__________cm。 (用含ρ、NA的计算式表示)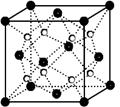
(6)甲、乙都能和丙形成原子个数比为1:3的常见微粒,推测这两种微粒的空间构型为
已知由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如下图所示,B、X为单质,D常温下为无色液体,A、B含同一种元素。(某些产物可能略去)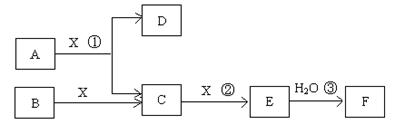
请回答下列问题:
(1)若E是有色气体,F是一元强酸,反应①是工业制备F的第一步反应。
①写出A与X反应的化学方程式:。
②有人认为“浓H2SO4可以干燥气体E”。某同学为了验证该观点是否正确,用下图装置进行实验。实验过程中,浓H2SO4中未发现有气体逸出,且浓H2SO4由无色变为红棕色,由此你得出的结论是。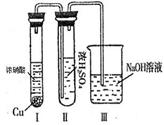
③已知常温下1 mol气体E发生反应③放出46kJ热量,写出气体E与H2O反应的热化学方式。
④在常温下,向V1L pH=a的A溶液中加入V2L pH=b的盐酸,且a+b=14,若反应后溶液的pH<7,则V1和V2的关系为V1V2(填>、<、无法确定),所得溶液中各种离子的浓度由大到小的顺序可能是。(写出一种情况即可)
(2)若E为无色无味气体,F是二元弱酸。
①E的电子式为;
②将少量气体E通入氢氧化钡溶液中得不溶物G,G的KSP=8.1×10-9。现将该沉淀放入0.1mol/L的BaCl2溶液中,其KSP,(填:增大、减小或不变),此时,组成不溶物G的阴离子在溶液中的浓度为mol/L。
丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知:①2C3H8(g)+7O2(g)=6CO(g)+8H2O(l);△H=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g)ΔH="-566" kJ/mol
(1)反应C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)的△H=
(2)C3H8在不足量的氧气里燃烧,生成CO和CO2以及气态水,将所有的产物通入一个固定体积的密闭容器中,在一定条件下发生如下可逆反应:
CO (g)+H2O(g) CO2(g)+H2 (g)
CO2(g)+H2 (g)
①下列事实能说明该反应达到平衡的是
a.体系中的压强不发生变化 b.υ正(H2)=υ逆(CO)
c.混合气体的平均相对分子质量不发生变化 d.CO2的浓度不再发生变化
② T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如下表:
| 时间 / min |
CO |
H2O(g) |
CO2 |
H2 |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
0.100 |
0.200 |
0.100 |
0.100 |
| 4 |
0.100 |
0.200 |
0.100 |
0.100 |
| 5 |
0.116 |
0.216 |
0.084 |
C1 |
| 6 |
0.096 |
0.266 |
0.104 |
C2 |
第5、6min时的数据是保持温度和体积不变时,改变某一条件后测得的。则第4~5min之间,改变的条件,第5~6min之间,改变的条件是。
已知420℃时,该化学反应的平衡常数为9。如果反应开始时,CO和H2O(g)的浓度都是0.01 mol/L,则CO在此条件下的转化率为。又知397℃时该反应的平衡常数为12,请判断该反应的△H0 (填“>”、“=”、“<”).
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;
燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2—。在电池内部O2—移向____极(填“正”或“负”);电池的负极反应式为。
(4)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为____。