下表为元素周期表的一部分,回答下列问题:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
Ⅶ |
0 |
| 2 |
|
|
|
|
① |
|
② |
|
| 3 |
③ |
④ |
⑤ |
⑥ |
|
⑦ |
⑧ |
⑨ |
| 4 |
⑩ |
? |
|
|
|
|
? |
|
(1)写出元素符号:①__________,④__________,⑥__________,⑦__________。
(2)若用M代表碱金属元素,则其最高价氧化物对应的水化物的化学式为__________;若用X表示卤族元素,则其气态氢化物的分子式为________;元素②、⑧、?的气态氢化物的稳定性由强到弱的顺序为______________________________(填化学式)。
(3)在元素③与⑩中,化学性质较活泼的是________(填元素符号),写出用化学实验证明它较活泼的方法:__________________________________________。
金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)写出Ti基态原子的电子排布。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。则电负性CB(选填“>”“<”),第一电离能N>O,原因是。
(3)月球岩石·玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。SO2—4的空间构型为,其中硫原子采用杂化,氧原子的价电子排布图为,任意写出一种SO2—4的等电子体。
(4)将TiOSO4的稀溶液加热水解后,经进一步反应,可得到钛的某种氧化物。该氧化物的晶胞结构图如图所示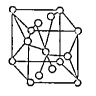 。则该氧化物的化学式(图中钛原子用“O”表示。氧原子用“O”表示)
。则该氧化物的化学式(图中钛原子用“O”表示。氧原子用“O”表示)
2012年冬天,我国城市空气污染状况受到人们的强烈关注。在空气质量报告中,SO2的指数是衡量空气质量好坏的重要指标。为了测定空气中的SO2含量,有三位同学分别采用了以下测定方法。
I.氧化还原法:甲同学拟采用下图所示的装置进行实验: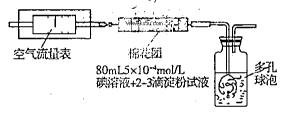
(1)该实验需要80mL5×10-4mol/L的碘溶液,甲同学应称量I2g(精确到0.001),选择_______mL的容量瓶进行配制。该实验所涉及的氧化还原反应原理为(用化学方程式表示),该实验原理是利用了SO2的性。
(2)在甲同学所配碘溶液浓度准确,并且量取药品及实验过程中各种读数均无错误的情况下,利用上述装置所测定的SO2含量仍然比实际含量低,请分析其中可能的原因.
Ⅱ.重量法:乙同学拟用右图 所示简易装置进行实验。实验操作如下:按图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2SO4)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.182mg。
所示简易装置进行实验。实验操作如下:按图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2SO4)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.182mg。
(3)取样处空气中SO2含量为mg/L(精确到0.001)。
(4)已知,常温下BaSO3的KSP为5.48×10-7饱和亚硫酸溶液中c(SO2-3)=6.3×10-8mol/L。有同学认为以上实验不必用H2O2吸收SO2,直接用0.1mol/L BaCl2溶液来吸收SO2即可产生沉淀,请用以上数据分析这样做是否可行.
III.仪器法:丙同学直接使用一种SO2浓度智能监测仪测定空气中的SO2含量,这种监测仪是利用电化学原理,根据电池产生电流的强度来准确测量SO2浓度的。该电池总的化学反应原理为:2SO2+O2+2H2O=2H2SO4
(5)请写出该电池负极的电极反应式。
已知尿素的结构式为: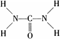 尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
(1)基态Fe3+的核外电子排布式为;C、N、O三种元素的第一电离能由大到小的顺序是。
(2)尿素分子中N原子的杂化方式是。
(3)NH+4中H—N—H键角比NH3中H—N—H键角大,原因为。
(4)CO2和NH3是工业上制备尿素的重要原料,固态CO2(干冰)的晶胞结构如图所示。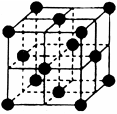
①1个CO2分子周围等距离且距离最近的CO2分子有个。
②NaCl晶胞也为面心立方结构,已知NaCl晶体密度为 g·cm-3NA表示阿伏加德罗常数,则NaCl晶胞体积为cm3
g·cm-3NA表示阿伏加德罗常数,则NaCl晶胞体积为cm3
下图表示某些化工生产的流程(部分反应条件和产物略去)
(1)反应Ⅰ需在500℃进行,其主要原因是。
(2)G转化为H的过程中,需要不断补充空气,其原因是。
(3)写出反应Ⅲ的化学方程式。
(4)工业上,向析出K的母液中通氨气,加入细小食盐颗粒,冷却后可析出副产品。通入氨气的作用是(填序号)。
a.增大NH+4的浓度,使J更多地析出
b.使K更多地析出
c.使K转化为M,提高析出的J的纯度
(5)写出上述流程所涉及的化学工业的名称。
运用化学反应原理研究氮、碳、硫等单质及其化合物的反应有重要意义。
(1)氨在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2mol NH3,放出92.2kJ热量。
①若起始时向容器内放入2mol N2和6mol H2,达平衡后放出的热量为Q,则Q(填 “>”、“<”或“=”)184.4 kJ。
②已知
1mol N—H键断裂吸收的能量等于kJ。
(2)硫酸的年产量可以用来衡量一个国家的化工生产能力。工业生产硫酸的流程中存在反应:2SO2(g)+O2(g) 2SO3(g)。反应体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g)。反应体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题: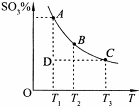
①该反应的 0(填“>’或“<”)。
0(填“>’或“<”)。
②下列说法正确的是
a.若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡不移动
b.在D点时,v正>v逆
c.B点、C点反应的平衡常数分别为K1、K2,则K1<K2
d.在A点时,消耗1mol SO2必定同时消耗1mol SO3
(3)过度排放CO2会造成温室效应。
①最近科学家提出“绿色自由”构想能把空气中的CO2转变为可再生燃料甲醇。甲醇可制作燃料电池,写出该电池负极反应式(电解液为KOH溶液)。
②CO2也可用NaOH溶液吸收得到Na2CO3溶液,写出该反应的离子方程式。
Na2CO3水溶液呈碱性,其原因是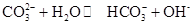 ,25℃时该反应的K=2×10-4mol·L-1,则当溶液中c(HCO- 3):c(CO2- 3)=2∶1时,溶液的pH=。
,25℃时该反应的K=2×10-4mol·L-1,则当溶液中c(HCO- 3):c(CO2- 3)=2∶1时,溶液的pH=。