某课外小组分别用下图所示装置对原电池和电解原理进行实验探究。
请回答:
I.用图1所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是 (填字母序号)。
| A.铝 | B.石墨 | C.银 | D.铂 |
(2)N极发生反应的电极反应式为 。
(3)实验过程中,SO42- (填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有 。
II.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
(4)电解过程中,X极区溶液的pH (填“增大” 、“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe - 6e- + 8OH-=FeO42- + 4H2O和
4OH- - 4e-= 2H2O + O2↑ ,若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少 g。
(6)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:
2K2FeO4 + 3Zn =Fe2O3 +ZnO +2K2ZnO2
该电池正极发生的反应的电极反应式为 。
.现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而得到较为纯净的NaNO3。实验流程可用下图表示: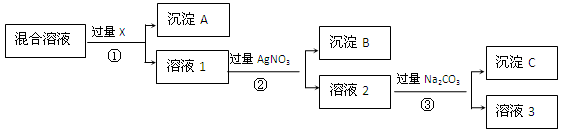
请回答下列问题:
(1)写出实验流程中下列物质的化学式:
试剂X:,沉淀B:。
(2)实验流程中加入过量的Na2CO3的目的是。
(3)实验方案得到的溶液3中肯定含有(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的,请写出所发生反应的离子方程式_______________。
.现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________
(2)该气体所含原子总数为个。
利用“化学计量在实验中的应用”的相关知识进行填空
(3)含有6.02×1023个氧原子的H2SO4的物质的量是_______
(4)与标准状况下VLCO2所含氧原子数目相同的水的质量是_______
(5)在一定的温度和压强下,1体积X2(g)跟3体积Y2(g)化合生成2体积化合物,则该化合物的化学式是_______________
(6)三种正盐的混合溶液中含有0.2 mol Na+、0 .25 mol M
.25 mol M g2+、0.4 mol Cl-、SO42—,则n(SO42—)为___________
g2+、0.4 mol Cl-、SO42—,则n(SO42—)为___________
(5分).丁达尔现象是区分胶体与溶液的一种最常用的方法。
(1)如图是在实验室中进行氢氧化铁胶体丁达尔现象实验的示意图,该图中有一处明显错误是___________,原因是___________(试从分散系的分类进行讨论说明)。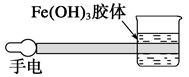
(2)欲在树林中观察到丁达尔效应,你认为一天中最有可能观察到该现象的时间是___________,理由是______ ____。
____。
(3)去树林观察丁达尔效应有诸多不便,聪明的你想出了许多在家里看到丁达尔效应的方法,其中最简单、最环保的方法是__________________ ________________。
________________。
(3分).选择萃取剂将碘水中的碘萃取出来,这种萃取剂应具备的性质是____________.
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是_____________________________。
(2)另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。写出生成Fe2+所有可能的离子反应方程式:。
若要确认其中有Fe2+,应选用(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.酸性KMnO4溶液
②乙同 学取336ml(标准状况)气体Y通入足量溴水中,发生反应的化学方程式为:。
学取336ml(标准状况)气体Y通入足量溴水中,发生反应的化学方程式为:。
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为。