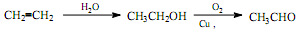用纯碱和双氧水混合可制作新型液体洗涤剂(2Na2CO3·3H2O2),它具有杀菌消毒去油污的能力且不会污染水源。
(1)写出H2O2的电子式______________。
(2)这种洗涤剂中的双氧水可以将废水中的氰化钠(NaCN)转化为无毒物同时生成NH3,写出反应的离子方程式:_________________________。
(3)如果配制洗涤剂的水中含有铁离子,不仅会削弱洗涤剂的去污能力,甚至完全失去杀菌作用。试分析其中的原因(结合文字表述和离子方程式说明):___________________。
在一固定容积为2L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g)+Q(Q>0),
2NH3(g)+Q(Q>0),
(1)该反应所用的催化剂是 (填写名称)
该反应450℃的平衡常数 500℃时的平衡常数(填“>”、“<”或“=”)。
(2)下列描述中能说明上述反应已达平衡的是
| A.3V正(H2)=2V逆(NH3) | B.容器中气体的平均分子量不随时间而变化 |
| C.容器中气体的密度不随时间而变化 | D.容器中气体的分子总数不随时间而变化 |
(3)如上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2mol计算从反应开始到平衡时,平均反应速率v(N2)为______________mol/(L¯min)。
(4)下列研究目的和示意图相符的是 。
| A |
B |
C |
D |
|
| 研究目的 |
压强对反应的影响(P1>P2) |
温度对反应的影响 |
平衡体系增加N2对反应的影响 |
催化剂对反应的影响 |
| 图示 |
 |
 |
 |
 |
以下反应①②可用于从不同原料中提取碘:
①2NaI+MnO2+3H2SO4 2NaHSO4+MnSO4+2H2O+I2
2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3 2Na2SO4+3NaHSO4+H2O+I2
2Na2SO4+3NaHSO4+H2O+I2
(1)反应①中的氧化剂是___________________;反应②中的还原产物是________________。
(2)根据反应①②可推知______。
a.氧化性:IO3->SO42-b.氧化性:MnO2>NaIO3
c.还原性:I->Mn2+d.还原性:I2>NaHSO3
(3)已知NaI和NaIO3在酸性条件下能反应生成I2 ,写出该反应的离子方程式:
③__________________________________________________________。
(4)三个反应中生成等量的I2时转移的电子数最少的是反应________(填序号)。
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
Ⅰ.处理NOx的一种方法是利用甲烷催化还原NOx。
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
CH4(g)+2NO2 (g)=N2(g) + CO2(g)+2H2O(g)△H3=-867kJ·mol-1
则△H2=。
Ⅱ. 化石燃料的燃烧、含硫金属矿石的冶炼和硫酸的生产过程中产生的SO2是大气中SO2的主要来源。(1)将煤转化为水煤气是将煤转化为洁净燃料的方法之一,反应为C(s) + H2O(g)= CO(g) + H2(g),
该反应的化学平衡常数表达式为K=。 800℃时,将1molCO、3mol H2O、1mol H2充入容积为1L的容器中,发生反应:CO(g) + H2O(g)  CO2(g) + H2(g),反应过程中各物质的浓度如右图t1前所示变化。若保持温度不变,t2时再向容器中充入CO、H2各1mol,平衡将移动(填“向左”、 “向右”或“不”)。t2时,若改变反应条件,导致H2浓度发生如图t2后所示的变化,则改变的条件可能是(填符号)。
CO2(g) + H2(g),反应过程中各物质的浓度如右图t1前所示变化。若保持温度不变,t2时再向容器中充入CO、H2各1mol,平衡将移动(填“向左”、 “向右”或“不”)。t2时,若改变反应条件,导致H2浓度发生如图t2后所示的变化,则改变的条件可能是(填符号)。
a加入催化剂b降低温度c缩小容器体积d减少CO2的量
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
①用离子方程式表示反应器中发生的反应。
②用化学平衡移动的原理分析,在 HI分解反应中使用膜反应器分离出H2的目的是。
Ⅲ.开发新能源是解决大气污染的有效途径之一。甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如图所示:
通入a气体的电极是原电池的极(填“正”或“负”),其电极反应式为。
卤代烃(R—X)在醚类溶剂中与Mg反应可制得格氏试剂,格氏试剂在有机合成方面用途广泛。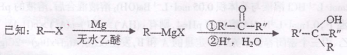
(R表示烃基,R′和 R”表示烃基或氢)
现某有机物A有如下转化关系:
试回答下列问题:
(1)B→C的反应类型是。
(2)B→A的化学反应方程式是。
(3)G的结构简式是。
(4)I中所含官能团的名称是。
(5)写出一种满足下列条件的物质I的同分异构体的结构简式。
①能发生银镜反应;②核磁共振氢谱有3个峰; ③拥有最多的甲基
(6)聚苯乙烯(PS)是一种多功能塑料,广泛应用于食品包装,绝缘板,商业机器设备等许多日常生活领域中。写出以 D和苯为主要原料制备聚苯乙烯的合成路线流程图(无机试剂任选)。合成路线流程图示例如下: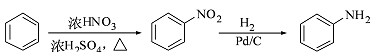
我国科研人员从天然姜属植物分离出的一种具有显著杀菌、消炎、解毒作用的化合物H。H的合成路线如下: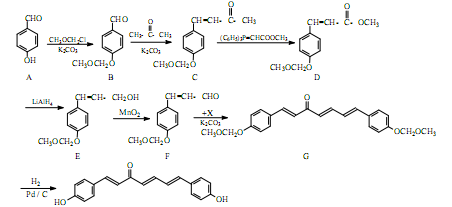
(1)A→B的反应类型是。
(2)化合物B中的含氧官能团为和(填官能团名称)。
(3)写出同时满足下列条件的B的一种同分异构体的结构简式。
I.苯环上有两个取代基;II.分子中有6种不同化学环境的氢;III.既能与FeCl3溶液发生显色反应,又能发生银镜反应,水解产物之一也能发生银镜反应。
(4)实现F→G的转化中,加入的化合物X(C12H14O3)的结构简式为。
(5)化合物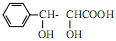 是合成紫杉醇的关键化合物,请写出以
是合成紫杉醇的关键化合物,请写出以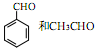 为原料制备该化合物的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
为原料制备该化合物的合成路线流程图(无机试剂任用)。合成路线流程图示例如下: