(一)一定温度下,在体积固定的密闭中加入2 mol X和1 mol Y,发生如下反应:2X(g) + Y(g)  a Z(g) + W(g) △H =-QkJ·mol-1 (Q>0)
a Z(g) + W(g) △H =-QkJ·mol-1 (Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值将 (填“增大”.“减小”或“不变”)。
(2)化学计量数a的值为 ,该反应的熵变△S 0(填“>”.“<”或“=”)。
(3)平衡后,若压缩容器体积,则再达到平衡后X的浓度将________(填“增大”、“减少”或“不变”) X的转化率α= (用含Q.Q1的代数式表示)。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是 (稀有气体不参与反应)。
| A.2 molX.1mol Y.1molAr | B.a molZ.1mol W |
| C.1 molX.0.5mol Y.0.5a molZ.0.5 mol W | D.4 molX.2mol Y |
(二)若在相同温度下,将2 mol X和1 mol Y加入到容积固定不变的甲容器中,将2amol Z和2 mol W加入到容积可变的乙容器中,t1=5 min时两容器内均达到平衡状态,甲中c(Z)=1.5 mol/L。
请回答下列问题:
(1)5 min内,用X物质表示甲容器中的平均反应速率v(X)=________。
(2)保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙容器中Z的物质的量浓度c(Z)________(填“>”“<”或“=”)3 mol/L。
(3)保持温度不变,t2时分别向甲、乙中加入等质量的氦气后,下图中能表示甲中反应速率变化情况的是________,能表示乙中反应速率变化情况的是________。
下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。
据此回答下列问题:
(1)该硫酸的物质的量浓度为mol/L。
(2)配制250mL 0.92mol·L-1的稀硫酸需取该硫酸mL。
(3)配制时必需的玻璃仪器有:
(4)定容时,若加入的水超过刻度线,必须采取的措施是
(5)下列操作对H2SO4的物质的量浓度有什么影响(偏高、偏低或无影响)?
①转移溶液后,未洗涤烧杯:;
②容量瓶用水洗净后未烘干:;
③定容时俯视容量瓶的刻度线:。
(6)在配置过程中,下列操作不正确的是(填序号)。
| A.使用容量瓶前检查它是否漏水 |
| B.容量瓶用蒸馏水洗净后,再用待配液润洗 |
| C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解. |
| D.将准确量取的18.4mol·L-1的硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线 |
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
(1)在60g 碳中含有的质子总数为;a mol H2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为。
(2)7.8g Na2R含有0.2mol Na+,则Na2R的摩尔质量为;含有R的质量为1.6g 的Na2R的物质的量为。
(3)标准状况下,3.4g NH3的体积为;它与标准状况下LH2S含有相同数目的氢原子。
现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________mol。
(2)该气体所含原子总数为________个。
(3)该气体在标准状况下的体积为____________L。
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为_______。
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为_____mol·l-1。
选择下列实验方法分离物质,将分离方法的序号填在横线上
A 萃取分液法 B 结晶法 C 分液法 D 蒸馏法 E 过滤法
①_____分离饱和食盐水与沙子的混合物。
②_____分离水和汽油的混合物。
③_____分离四氯化碳(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。
④____从碘的水溶液里提取碘。
⑤_____从硝酸钾和氯化钠的混合液中获得硝酸钾。
通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下: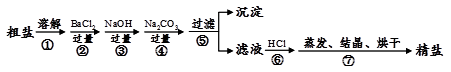
(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是。
(2)第②步操作的目的是除去粗盐中的(填化学式,下同),第⑥步操作的目的是除去滤液中。
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、、(填化学式)。
(4)判断加入的盐酸“适量”的方法是。
(5)第③步的化学方程式为__________________________________________
第④步的化学方程式为______________________________、_______________________________