为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):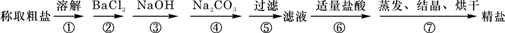
(1)第⑤步实验操作需要烧杯、____________、___________等玻璃仪器。
(2)步骤2中,判断加入BaCl2已过量的方法是:
(3)除杂试剂BaCl2、NaOH、Na2CO3、加入的顺序还可以是(用化学式回答) 。
(4)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是_____________________________。
(5)为检验精盐纯度,需配制200 mL 1 mol/L NaCl(精盐)溶液,下图是该同学转移溶液的示意图,图中的错误是: 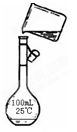
(6)配制过程中,下列操作情况会使结果偏低的是
| A.称量时,托盘天平左盘加砝码,右盘加氯化钠 |
| B.移液前,容量瓶中有少量蒸馏水未倒出 |
| C.定容时,俯视容量瓶刻度线观察液面 |
| D.定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,再加水定容 |
Cl2O为国际公认高效安全灭菌消毒剂之一,它是棕黄色强刺激性气体,沸点3.8℃熔点-116℃。实验室可用潮湿的Cl2与Na2CO3反应制取少量Cl2O,装置如下(图Ⅰ):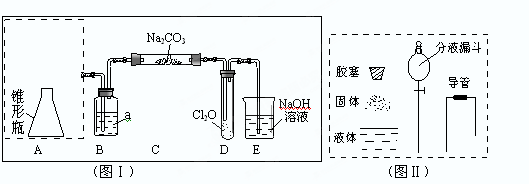
回答下列问题:
(1)把浓盐酸直接滴在KMnO4晶体上就可以产生Cl2。请模仿“图Ⅱ”在“图Ⅰ”A处补画出正确的装置图,并作必要的标注。
(2)B中试剂a应选用(填下列序号字母):
a.CCl4 b.饱和NaCl溶液 c.浓H2SO4d.饱和NaHCO3溶液
(3)通入适量的氯气,在C中生成棕黄色的物质Cl2O,该物质常温下为气体,方程式为:
Cl2+Na2CO3+=NaHCO3+NaCl+Cl2O
(4)对C中反应后的固体成分进行检验,请写出实验步骤以及预期的现象和结论。限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、澄清石灰水、试管、小烧杯、带导管的橡皮塞、过滤装置。
| 实验步骤 |
现象和结论 |
| 步骤一:取C中的少量固体样品于试管中,滴加足量蒸馏水至完全溶解,然后将溶液分别置于a、b试管中。 |
|
| 步骤二:向a试管中滴加BaCl2溶液,静置。 |
无明显现象,证明固体中不含Na2CO3 |
| 步骤三: |
|
| 步骤四: |
则证明固体中含有NaCl。 |
某校化学小组学生利用右图所示装置进行“铁与水反应”的实验,并探究固体产物成分(图中夹持及尾气处理装置均已略去)。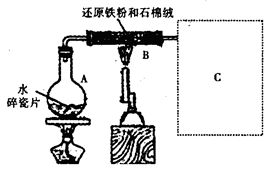
(1)装置B中发生反应的化学方程式是。
(2)虚线框图C的气体收集装置是下图中的________________________(选填字母编号)。
(3)反应停止,待B管冷却后,称量,得到固体质量为28.8g。再向固体中加入过量稀盐酸充分反应,并进行如下实验:
试剂a的化学式是,试剂b的化学式是;加入新制氯水后溶液红色加深的原因是(用离子方程式表示)。
(4)某同学在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,现请对褪色原因进行探究。首先提出假设。假设1:溶液中的+3价铁被氧化为更高的价态;
假设2:;
为了对所提出的假设2进行验证,实验方案是。
(5)根据所给数据,可计算出反应后B装置中铁元素的质量分数为。
(14分)氯气是一种重要的化工原料。某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。
(1)若D中品红溶液褪色,则B装置中发生反应的离子方程式是。
(2)证明FeBr2与Cl2发生了氧化还原反应后各被氧化粒子的检验方法是。
某研究性学习小组用刚吸收过少量SO2的NaOH溶液吸收处理上述实验后的尾气。经分析吸收尾气一段时间后,吸收液(呈强碱性)中肯定存在Cl-、OH-和SO42-,对于可能存在的其他阴离子,研究小组提出以下3种假设:
假设1:只存在SO32-;假设2:只存在ClO-;假设3:既不存在SO32-,也不存在ClO-。
(3)学习小组判断同时存在SO32-和ClO-是不可能的理由是______________。(用离子方程式解释)
(4)现限选以下试剂,设计实验方案,进行实验,请写出实验步骤以及预期现象和结论。
a.3 mol/L H2SO4 b.0.01 mol/L KMnO4c.1 mol/L BaCl2溶液
d.淀粉碘化钾溶液 e.酚酞试液
步骤一:取少量吸收液于试管中,滴加3 mol/L H2SO4至溶液呈酸性,然后将所得溶液分装于A、B两试管中。
步骤二:向A试管中滴加少量___ (填字母),若溶液_________________(填现象),则假设1成立。
步骤三:向B试管中滴加少量_____(填字母),若溶液_________________(填现象),则假设2成立。
某课外活动小组设计了以下实验方案验证Ag与浓HNO3反应的过程中可能产生NO2,其实验流程图如下:
(1)测定硝酸的物质的量反应结束后,从如下图B装置中所得100mL溶液中取出25.00ml溶液,用0.1mol/L的NaOH溶液滴定,用酚酞作指示,滴定前后的滴定管中液面的位置如上图所示,在B容器中生成硝酸的物质的量为,则Ag与浓硝酸反应过程中生成的NO2的物质的量为。
(2)测定NO的体积
①从上图所示的装置中,你认为应选用装置进行Ag与浓硝酸反应实验,选用的理由是。
②在读取量筒内液体体积之前,应进行的操作。
(3)气体成分分析
若实验测得NO的体积为112.0ml(已折算到标准状况),则Ag与浓硝酸反应的过程中(填“有”或“没有”)NO产生,作此判断的依据是。
(14分)某学习小组探究浓、稀硝酸氧化性的相对强弱的,按下图装置进行试验(夹持仪器已略去)。实验表明浓硝酸能将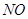 氧化成
氧化成 ,而稀硝酸不能氧化
,而稀硝酸不能氧化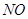 。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与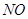 反应,能与
反应,能与 反应
反应
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是
(2)滴加浓硝酸之前先检验装置的气密性,再加入药品,打开弹簧夹后
(3)装置①中发生反应的化学方程式是
(4)装置②的作用是,发生反应的化学方程式是
(5)该小组得出的结论依据的试验现象是
(6)试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了4个试验来判断两种看法是否正确。这些方案中可行的是(选填序号字母)
| A.加热该绿色溶液,观察颜色变化 |
| B.向该绿色溶液中通入氮气,观察颜色变化 |
| C.加水稀释绿色溶液,观察颜色变化 |
| D.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化 |