在火箭推进器中装有还原剂液态肼(N2H4)和强氧化剂液态H2O2,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热量。已知一些键断裂所需能量数据:
N-N:159 kJ /mol N="N:419" kJ /mol N≡N:945 kJ /mol H-H:436 kJ /mol
N-H:389 kJ /mol H-O:465 kJ /mol O-O:138 kJ /mol O="O:498" kJ /mol
①写出肼和过氧化氢的结构式:肼______ ___,过氧化氢______
②写出肼和双氧水反应的热化学方程式_____________________________。
前不久媒体报道某品牌白酒塑化剂超标2.6倍,塑化剂并非食品或食品添加剂,且对人体有害。一种塑化剂DIBP仅含C、H、O三种元素,相对分子质量小于280,氧的百分含量为23.02%, DIBP分子中苯环上二位取代,且分子中含2个酯基。
(1)DIBP的分子式为。
(2)塑化剂DEHP是DIBP的同系物,存在如图所示的转化关系。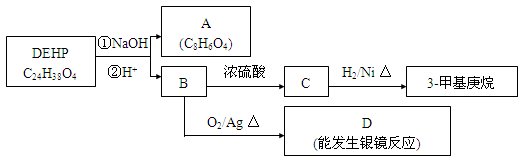
①A是苯环的邻二位取代,则A的结构简式是。
A与乙二醇发生缩聚反应的化学方程式为。
②D分子所含官能团的名称是。
③B分子有1个碳原子连接乙基和正丁基,DEHP的结构简式是。
(3)F是A的一种同分异构体,具有如下特征:
a.是苯的邻位二取代物;
b.遇FeCl3溶液显示特征颜色;
c.能与NaHCO3溶液反应。
写出F与足量NaHCO3溶液反应的化学方程式。
(4)有机物M与DIBP也互为同系物,分子式为C10H10O4, M核磁共振氢谱出现三组峰,则有机物M的结构共有种。
已知A、B、C、D、E、F、G位于元素周期表的前四周期,且元素原子序数依次增加,A焰色反应呈黄色;工业常用电解B的熔融的氯化物来制备B,C是一种能被HF和NaOH溶液溶解的单质,D的电负性比磷大,第一电离能却比磷小,E单质是制备漂白液的原料,F能形成红色(或砖红色)和黑色的两种氧化物,G是一种主族金属。
(1)前四周期所有元素中,基态原子中未成对电子与其所在周期数相同的元素有种。
(2)元素A、B、C分别与氟气化合形成物质X、Y、Z熔点见下表:
| 氟化物 |
X |
Y |
Z |
| 熔点/K |
1266 |
1534 |
183 |
解释表中氟化物熔点差异的原因:。
(3)已知常温条件下,极性分子DOE2是一种液态化合物,中心原子D的杂化方式是。向盛有10mL水的锥形瓶中滴加少量的DOE2溶液,生成两种有刺激性气味的气体。请书写此反应的化学方程式。
(4)G与氮原子可1:1化合,形成人工合成的新型半导体材料,其晶体结构与单晶硅相似。G原子的价电子排布式为。在该合成材料中,与同一个G原子相连的N原子构成的空间构型为正四面体。在四种基本晶体类型中,此晶体属于晶体。
(5)F晶体的堆积方式是(填堆积名称),其配位数为。 向F的硫酸盐溶液中滴加氨水直至过量,写出此过程所涉及的两个离子方程式根据价层电子对互斥理论,预测SO42-的空间构型为。
氢能被视为未来的理想清洁能源,科学家预测“氢能”将是21世纪最理想的新能源。目前分解水制氢气的工业制法之一是“硫—碘循环”,主要涉及下列反应:
Ⅰ SO2+2H2O+I2= H2SO4+2HI Ⅱ 2HI H2+I2
H2+I2
Ⅲ 2H2SO4= 2SO2↑+O2↑+2H2O
(1)分析上述反应,下列判断正确的是。
a.反应Ⅲ易在常温下进行 b.反应I中SO2还原性比HI强
c.循环过程中需补充H2O d.循环过程中产生1molO2的同时产生1molH2
(2)一定温度下,向2L密闭容器中加入1mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。0—2min内的平均反应速率v(HI)= 。该温度下,反应2HI(g) H2(g)+I2(g)的平衡常数K=。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则是原来的2倍。
H2(g)+I2(g)的平衡常数K=。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)SO2在一定条件下可被氧化生成SO3,其反应为:2SO2 (g) + O2(g)  2SO3(g)△H<0。某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。
2SO3(g)△H<0。某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。 
①a电极的电极反应式为;
②若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为。
(4)实际生产还可以用氨水吸收SO2生成亚硫酸的铵盐。现取a克该铵盐,若将其中的SO2全部反应出来,应加入10 mol/L的硫酸溶液的体积范围为。
工业上常以软锰矿、闪锌矿(除主要成分为MnO2、ZnS外还含有少量的FeS、CuS、Al2O3等物质)为原料制取Zn和MnO2。
(1)已知将MnO2、ZnS浸在硫酸溶液中有少量黄色物质析出,写出并配平该化学反应方程式:。
(2)在酸浸的过程中还会发生以下反应:
a. 3MnO2 +2FeS +6H2SO4=3MnSO4 +Fe2(SO4)3+2S+ 6H2O
b. MnO2+CuS+4H2SO4=MnSO4+CuSO4+S+2H2O
c. Al2O3+3H2SO4=Al2(SO4)3+3H2O
将酸浸所得的酸性溶液按以下的工业流程进行操作处理得溶液(Ⅳ),电解溶液(Ⅳ)即得MnO2和Zn。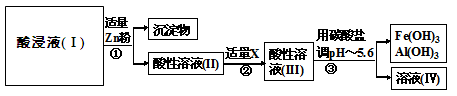
①操作①中加Zn粉后发生反应的离子方程式为:Zn+2H+=Zn2++H2↑、
Zn+Cu2+=Zn2++Cu、。
②操作②中加入适量X的作用是:。
③操作③中所加碳酸盐的化学式是:。
(3)为了从上述流程中产生的Fe(OH)3 、Al(OH)3沉淀混合物中回收Al(OH)3,某化学兴趣小组设计了如下两种方案图。
方案Ⅰ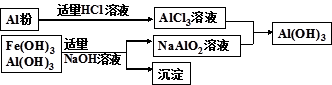
方案Ⅱ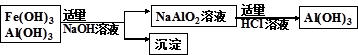
①方案Ⅰ中,AlCl3溶液和NaAlO2溶液反应生成Al(OH)3的离子方程式为:
。若总共得到n molAl(OH)3,则消耗的NaOH和HCl的理论量分别为:mol、mol。
②从消耗酸碱的用量角度考虑,方案 (填“Ⅰ”或“Ⅱ”)所消耗的酸碱少些。
将一螺旋状的铜丝放在酒精灯上灼烧,然后将热的铜丝插入盛有乙醇的试管中。整个反应过程中铜丝表面的颜色变化是,反应的化学方程式为。