(10分)生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与混合,在含有Zn、Cu等元素的催化剂条件下能合成一种生物质能——甲醇。
(1) 与CO互为等电子体的物质的化学式是 。
(2) CO2分子中碳原子的杂化类型是 杂化。
(3) 按电子排布Zn在元素周期表中属于 区,其晶体属于六方最密堆积,它的配位数是 。
(4) Cu的一种氯化物晶体的晶胞结构如右图所示(空心球代表氯离子),则一个晶胞中所含的数目是 。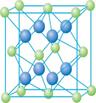
(7分)(1)常温下,已知0.1 mol·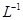 一元酸HA溶液中
一元酸HA溶液中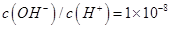 ,则溶液的pH=_____________。
,则溶液的pH=_____________。
①pH=3的HA与pH=l1的NaOH溶液等体积混合;反应的离子方程式为______________;混合溶液中,各离子的物质的量浓度大小关系是____________;
②0.2 mo·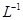 HA溶液与0.1 mol·
HA溶液与0.1 mol·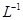 NaOH溶液等体积混合后所得溶液中(溶液体积变化忽略不计):
NaOH溶液等体积混合后所得溶液中(溶液体积变化忽略不计):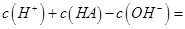 ____________mol·
____________mol·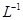 。
。
(2)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw=___________。
①该温度下(t℃),将100mL0.1 mol·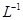 的稀H2SO4与100mL0.4 mol·
的稀H2SO4与100mL0.4 mol·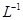 的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=___________;
的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=___________;
②该温度下(t℃),1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则稀硫酸的pH(pHa)与NaOH溶液的pH(pHb)的关系是_______________。
(9分)对合成氨的研究具有很高的应用价值。
在三个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应: ,按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据如下表:
,按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据如下表:
(1)下列能说明该反应已达到平衡状态的是___________(填字母序号)。
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t_________5min(填“>”、“<”或“=”)。
(3)乙中从反应开始到平衡时N2的化学反应速率为__________________。
(4)分析上表数据,下列关系正确的是_________(填字母序号)。
a. mol·
mol· b.
b. c.
c.
(5)该温度下,反应的化学平衡常数K=______________(用分数表示)。
(9分)电化学原理在医学医疗中有重要应用。
(1)碘可用作心脏起搏器电源—锂碘电池的材料。该电池反应如下:
已知:2Li(s)+I2(s)=2LiI(s)△H
4Li(s)+O2(g)=2Li2O(s)△H1
4LiI(s)+O2(g)=2I2(s)+2Li2O(s)△H2
则△H=______________;碘电极作为该电池的_______极。
(2)人工肾脏可采用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],其原理如图所示。
请回答下列问题:
①直流电源的负极为___________(填“A”或“B”);
②阳极室中发生的反应依次为______________________、_______________________;
③电解结束后,阴极室溶液的pH与电解前相比将_____________(填“增大”、“减小”或“不变”);若两极共收集到气体13.44L(标准状况),则除去的尿素为___________g(忽略气体的溶解)。
(8分)短周期元素X、Y、Z、W在周期表中的位置关系如图所示。已知在同周期元素的常见简单离子中,W的离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛。
(1)X元素在元素周期表中的位置是___________________。
(2)X、Y、Z元素的氢化物均有两种或两种以上。
①液态YH3的电离方式与液态H2Z类似,则液态YH3中阴离子的电子式为____________________;
②在一定条件下X2H4与H2Z可发生反应,化学方程式为_____________,反应类型为__________。
(3)以W为材料制成的容器在空气中具有自我保护作用,这种容器不能贮存强碱溶液,用离子方程式表示其原因为____________________________________________。
(4)超细WY粉末被应用于大规模集成电路领域。其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:l;其反应的化学方程式为___。
周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)e的基态原子电子排布式为_______。
(2)b、c、d的第一电离能由大到小的顺序是_________(填元素符号)
(3)a和其他元素形成的二元共价化合物中,分子中既含有极性共价键、又含有非极性共价键的化合物是________(填化学式)。
(4)d与c可以形成两种分子,低价态分子中心原子的杂化方式为_______该分子的空间构型为______________
(5)e和c形成的一种离子化合物的晶体结构如图,则该离子化合物的化学式为__________。(填元素符号)