已知
(1)H2( g )+ O2 ( g ) = H2O ( g ) ΔH1 =" a" kJ/mol
O2 ( g ) = H2O ( g ) ΔH1 =" a" kJ/mol
(2)2H2( g )+O2 ( g ) =2H2O ( g ) ΔH2 =" b" kJ/mol
(3) H2( g )+ O2 ( g ) = H2O ( l ) ΔH3 =" c" kJ/mol
O2 ( g ) = H2O ( l ) ΔH3 =" c" kJ/mol
(4) 2H2( g )+O2 ( g ) =2H2O ( l ) ΔH4 =" d" kJ/mol
则a、b、c、d的关系正确的是( )。
| A.c<a<0 | B.b>d>0 | C.2a=b< 0 | D.2c=d>0 |
已知某可逆反应:mA(g) + nB(g)="==" pC(g)在密闭容器中进行,右图表示反应在不同时间t、温度T和压强P与反应物B在混合气体的体积分数(B%)的关系曲线。由曲线分析下列判断正确的是()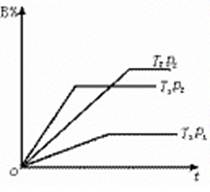
| A.T1<T2 P1 >P2m + n >p 正反应为吸热反应 |
| B.T1 >T2 P2 >P1 m +n< p 正反应为吸热反应 |
| C.T2 >T1 P2 >P1m + n< p 正反应为吸热反应 |
| D.T1 >T2 P2 >P1 m +n< p 正反应为放热反应 |
有一处于平衡状态的反应:X(气)+3Y(气)===2Z(气)(正反应为放热反应)。为了使平衡向生成Z的方向移动,应选择下列的适宜条件是()
①高温②低温③高压④低压⑤加催化剂⑥除去Z
| A.①④⑥ | B.②③⑤ | C.①③⑥ | D.②③⑥ |
对于可逆反应:N2+3H2===2NH3,下列方法可以增加反应物分子中活化分子百分数的是()
| A.降低温度 | B.增大压强 | C.减少NH3 | D.使用催化剂 |
能确认发生了化学平衡移动的是()
| A.化学反应速率发生了变化 | B.物质的浓度发生了变化 |
| C.有气体参加的可逆反应达平衡后,对容器的压强增大 | |
| D.由于某一条件的改变,平衡混合物中各组分物质的浓度发生了不同程度的改变 |
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如右图。反应中镁和铝的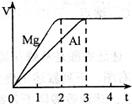
| A.物质的量之比为3∶2 | B.质量之比为3∶2 |
| C.摩尔质量之比为2∶3 | D.反应速率之比为2∶3 |