某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________________.
(2)上述(B)操作不用标准溶液润洗滴定管,则对测定结果的影响是(填偏大、偏小、不变,下同)_____________。
(3)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是___________。
类比是一种重要的科学研究方法。某化学实验小组类比AgOH能溶于氨水的性质,猜测Cu(OH)2也具有同样的性质,并对此进行实验探究:
(1)写出AgOH与氨水反应的离子方程式_____________________________________。
(2)甲组同学进行如下操作:向干燥洁净的试管中加入CuSO4溶液,再向其中逐滴加入氨水,观察到蓝色沉淀生成;继续滴加,观察现象,由此得出Cu(OH)2可溶于氨水的结论。
①写出生成蓝色沉淀的离子方程式:_______________________________________________
②写出向沉淀中滴加氨水的实验现象:______________________________________________
(3)乙组同学向CuSO4溶液中滴加NaOH溶液,制得Cu(OH)2悬浊液A,向其中加入足量氨水,始终未观察到(2)中的现象。甲乙两组同学在对他们的实验及现象进行比对后,决定对Cu(OH)2与氨水反应的机理进行探究:
①该实验小组的同学取一定量上述制得的Cu(OH)2悬浊液A,向其中加入足量饱和NH4Cl溶液,结果观察到(2)中现象。据此,有同学认为由于饱和NH4Cl溶液的加入引入了Cl—,致使Cu(OH)2与氨水的反应得以发生,而指导老师表示这一观点是不成立的。为了排除Cl—的干扰,该组同学又做了如下实验:取一定量上述制得的Cu(OH)2悬浊液A,向其中加入饱和___________溶液(填化学式),结果同样观察到(2)中的现象,据此可知该反应的发生与Cl—无关。
②因此,同学们又提出:Cu(OH)2与氨水的反应的发生需要NH4+的参与,于是同学们进一步探究:向干燥洁净的试管中加入CuSO4溶液,再向其中逐滴加入氨水,观察到蓝色沉淀生成。通过离心的方法得到Cu(OH)2沉淀。将沉淀洗涤后,置于干燥洁净的试管中,向试管中滴加足量饱和氨水,为观察到(2)中现象,再向试管中滴加足量饱和NH4Cl溶液,观察到(2)中现象。
(i)检验是否沉淀洗涤干净的操作是___________________________________________
(ii)据此,可以得出结论:在Cu(OH)2与氨水的反应中,NH4+起着至关重要的作用,且________________对反应的发生有影响。
(4)试从溶解平衡角度解释上述反应发生过程中NH4+的作用:___________________________。
某校兴趣小组用如图Ⅰ装置制取漂白液(气密性已检验,试剂已添加),并研究其相关性质。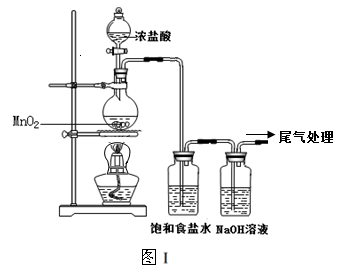
实验操作和现象:打开分液漏斗的活塞,缓缓滴加一定量浓盐酸,点燃酒精灯;一段时间后,关闭分液漏斗的活塞,熄灭酒精灯。
(1)烧瓶中反应的化学方程式是。
(2)饱和食盐水的作用是。
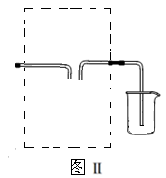
(3)若用图Ⅱ装置收集多余的氯气,请在虚线框内画出该装置简图。
(4)该小组同学用上述装置制得的漂白液中NaClO的浓度偏低。
查阅资料:在溶液中发生反应:
(a)Cl2(g)+2NaOH(aq)═ NaCl(aq)+NaClO(aq)+H2O(l)H1=-101.1kJ/mol
(b)3NaClO(aq)═2NaCl(aq)+NaClO3(aq)H2=-112.2kJ/mol
反应(a)的反应速率很快,反应(b)在室温下较慢
根据资料,请对图Ⅰ装置提出改进建议:。
(5)修改方案后,该小组同学制得了较高浓度的NaClO溶液。他们把漂白液和滴有酚酞的红色Na2SO3溶液混合后,得到无色溶液。
提出猜想:ⅰ.NaClO把Na2SO3氧化了
ⅱ.NaClO把酚酞氧化了
ⅲ.NaClO把Na2SO3和酚酞均氧化了
①下列实验方案中可以证明NaClO氧化了Na2SO3的是。
a.向混合后的溶液中加入过量盐酸
b.向混合后的溶液中加入过量盐酸,再加入氯化钡溶液
c.向混合后的溶液中加入过量硝酸,再加入硝酸银溶液
d.向混合后的溶液中加入氢氧化钡溶液,再加入过量盐酸
②为证明NaClO氧化了酚酞,可进行的实验是。
下面是提纯大理石(主要杂质是氧化铁)的流程图:
按要求回答下列问题:
(1)在工业生产中,将块状大理石磨成粉末,并在反应池中安装搅拌机。目的是________。
(2)操作Ⅱ中A物质最好应选择___________(填化学式),在该过程中要随时测定pH,在实验室中用pH试纸测定溶液pH的操作是______________________________。
(3)检验Fe3+已完全生成Fe(OH)3沉淀的方法是________________________________。
(4)由滤液B得到晶体B,操作过程包括___________(填操作名称)、冷却结晶。
(5)某化学小组在实验中用浓硝酸和铜反应制取二氧化氮并探究二氧化氮是否能支持木炭的燃烧,其实验装置图如下: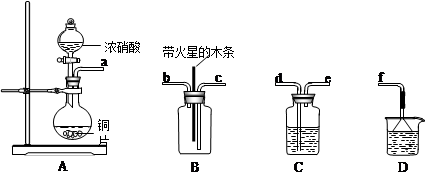
①按气流方向连接各仪器接口,顺序为a→______→______→______→______→f。装置C、装置D 的作用分别是__________________、__________________。
②实验开始后,能证明二氧化氮支持燃烧的实验现象是_______________________。
③已知二氧化氮和碳反应生成两种物质的量比为1:1有毒气体,则该反应的化学方程式为:___________________________。
钛(Ti)具有高强度和耐酸腐蚀性,是重要的工业原料。以金红石(主要成分为TiO2,含少量Fe2O3、SiO2)为原料可制取Ti。工业流程如下: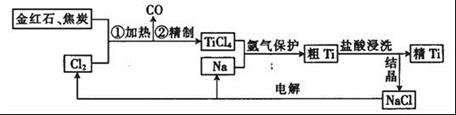
(1)粗TiCl4中含有少量FeCl3、SiCl4等,它们的部分性质如下:
从粗TiCl4中精制TiCl4的方法是________(填字母)。
A.用水溶解后,重结晶 B.蒸馏 C.用乙醚萃取后,分液
(2)写出用惰性电极电解熔融NaCl时阳极的电极反应式:_________________;阴极产物是__________。
(3)Ti可溶解在浓HF溶液中,请完成下列离子方程式:
(4)如图是一个制取氯气并以氯气为原料进行反应的装置,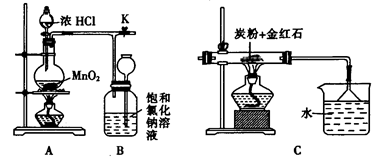
①装置A中发生反应的化学方程式为_____________________________________。
②在实验室中,某同学欲用如图所示装置净化氯气,则M、N中应盛放的试剂分别是__________、__________。(填试剂名称)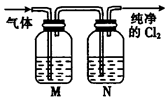
③实验开始时,先点燃A处的酒精灯,打开旋塞K,让C12充满整个装置,再点燃C处酒精灯。Cl2通过装置M、N再进入装置C,与装置C中的固体粉末发生氧化还原反应生成CO气体。试写出装置C中发生反应的化学方程式:_________________________。
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。有研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。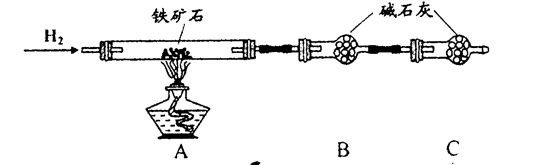
实验一:铁矿石中含氧量的测定
a.按上图组装仪器(夹持仪器均省略),检查装置的气密性;
b.将5.0g铁矿石放入硬质玻璃管中;
c.从左端导气管口处不断地缓缓通入H2,待C装置出口处对H2验纯后,点燃A处酒精灯;
d.充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)装置C的作用为_______________________________________________________。
(2)测得反应后装置B增重1.35g,则铁矿石中氧的质量分数为______________________。
实验二:铁矿石中含铁量的测定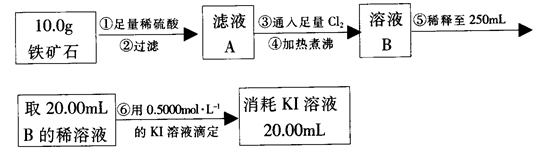
(3)步骤④中煮沸的目的是_____________________________________________。
(4)步骤⑤中用到的玻璃仪器有烧杯、胶头滴管、_________________________。
(5)下列有关步骤⑥的操作中说法不正确的是_______________________________。
a.滴定管用蒸馏水洗涤后再用待装液润洗
b.锥形瓶不需要用待测液润洗
c.因为碘水为黄色,所以滴定过程中不需加指示剂
d.滴定过程中可利用淀粉溶液作为指示剂
(6)铁矿石中铁的质量分数为______________________________________________。
实验结论:推算铁的氧化物的组成
(7)由实验一、二得出该铁矿石中铁的氧化物的化学式为____________________________。